抗体
抗體(antibody),又稱免疫球蛋白(,簡稱Ig)[1],是一种主要由浆细胞分泌,被免疫系统用来鉴别与中和外来物质如细菌、病毒等病原体的大型Y形蛋白质,仅被发现存在于脊椎动物的血液等体液中,及其B细胞的细胞膜表面[2][3]。抗体能通过其可变区唯一识别特定外来物的一个独特特征,该外来目标被称为抗原。蛋白上Y形的其中两个分叉顶端都有一被称为互补位(抗原結合位)的锁状结构,该结构仅针对一种特定的抗原表位。这就像一把钥匙只能开一把锁一般,使得一种抗体仅能和其中一种抗原相结合。 抗体和抗原的结合完全依靠非共价键的相互作用,这些非共价键的相互作用包括氢键、范德华力、电荷作用和疏水作用。这些相互作用可以发生在侧链或者多肽主干之间。正因这种特异性的结合机制,抗体可以“标记”外来微生物以及受感染的细胞,以诱导其他免疫机制对其进行攻击,又或直接中和其目标,例如通过与入侵和生存至关重要的部分相结合而阻断微生物的感染能力等,就像通緝犯上了手銬和腳鐐一樣。针对不同的抗原,抗体的结合可能阻断致病的生化过程,或者召唤巨噬细胞消灭外来物质。而抗体能够与免疫系统的其它部分交互的能力,是通过其Fc区底部所保留的一个糖基化座实现的[4]。体液免疫系统的主要功能便是制造抗体[5]。抗体也可以与血清中的补体一起直接破壞外来目标。

抗體主要由一種B细胞所分化出来的叫做漿細胞的淋巴細胞所製造。抗体有两种物理形态,一种是从细胞分泌到血浆中的可溶解物形态,另一种是依附于B细胞表面的膜结合形态。抗体与细胞膜结合后所形成的复合体又被称为B细胞感受器(B Cell Receptor,BCR),这种复合体只存在于B细胞的细胞膜表面,是激活B细胞以及后续分化的重要结构。B细胞分化后成为生产抗体的工厂的浆细胞,或者长期存活于体内以便未来能迅速抵抗相同入侵物的记忆B细胞[6]。在大多数情况下,与B细胞进行互动的辅助型T细胞对于B细胞的完全活化是至关重要的,因为辅助型T细胞负责识别抗原,并促使B细胞能分化出能与该抗原相结合的抗体的浆细胞和记忆型B细胞[7]。而可溶性抗体则被释放到血液等体液当中(包括各种分泌物),持续抵抗正在入侵的外来微生物。
抗体是免疫球蛋白超家族中的一种醣蛋白[4]。它们是血浆中丙种球蛋白的主要构成成分。抗体通常由一些基础单元组成,每一个抗体包括:两个長(大)的重链,以及两个短(小)的轻链。而輕鏈和重鏈之間以雙硫鍵連接。輕鏈和重鏈又分為可變區和恆定區,而不同类型的重链恆定區,将会导致抗体种型的不同。在哺乳类动物身上已知的不同种型的抗体有五种,它们分别扮演不同的角色,并引导免疫系统对所遇到的不同类型外来入侵物产生正确的免疫反應[8]。
尽管所有的抗体大体上都很相似,然而在蛋白质Y形分叉的两个顶端有一小部分可以发生非常丰富的变化。这一高变区上的细微变化可达百万种以上,该位置就是抗原结合位。每一种特定的变化,可以使该抗体和某一个特定的抗原结合[2]。这种极丰富的变化能力,使得免疫系统可以应对同样非常多变的各种抗原[1]。之所以能产生如此丰富多样的抗体,是因为编码抗体基因中,编码抗原结合位(即互补位)的部分可以随机组合及突变[8][9]。此外,在免疫种型转换的过程中,可以修改重链的类型,从而制造出对相同抗原專一性的不同种型的抗体,使得同种抗体可以用于不同的免疫系统过程中。
形态
表面免疫球蛋白通过跨膜部分附着在B细胞的细胞膜上,而分泌到血液等体液中的抗体则没有该跨膜部分。这两种抗体除了是否存在跨膜部分之外,结构是完全相同的。根据这一区别,抗体被分为两种形态:可溶形态(分泌形态)及膜结合形态。
膜结合形态抗体可称为“表面免疫球蛋白”(sIg)或者“膜免疫球蛋白”(mIg),是B细胞感受器的其中一部分。当体内存在某种抗原的时候,会与该蛋白结合,并激活B细胞[10]。B细胞感受器由表面免疫球蛋白(IgD或IgM),以及与之相连接的由Ig-α和Ig-β构成的异源二聚体所组成,其中后者负责传递抗原刺激信号[11]。人类B细胞表面所拥有抗体的典型数量为5万至10万左右[11]。这些抗体通常会聚集在每个直径大约1微米的脂筏上,这些脂筏用于隔离细胞上的其它信号感受器[11],这种聚集方式可能可以提升细胞媒介性免疫的效率[12]。在人类B细胞的表面,这些B细胞感受器聚集的脂筏周围几百纳米的范围内没有其它感受器,以避免互相竞争的影响[13]。
分類表格
| 名称 | 类型数 | 形状 | 描述 | 抗体复合物 |
| IgA | 2 | Y型、雙Y型 | 存在于粘膜组织,例如消化道、呼吸道以及泌尿生殖系统,以避免遭到病原的入侵[14],也存在于唾液、泪液以及乳汁当中,尤其是初乳,其IgA的含量相當高。 |  其中一些抗体复合体可以与多个抗原分子结合。 其中一些抗体复合体可以与多个抗原分子结合。 |
| IgD | 1 | Y型 | 主要出现在尚未遇到过抗原的B细胞上的抗原感受器[15],用于刺激嗜碱性粒细胞及肥大细胞生产抗菌因子[16] | |
| IgE | 1 | Y型 | 与致敏原相结合,刺激肥大细胞和嗜碱性粒细胞释放组织胺。该种型与过敏反应有关,同时也保护机体免受寄生虫的威胁[5]。 | |
| IgG | 4 | Y型 | 抵抗病原入侵的抗体相关免疫力,主要由该种型下的四种类型所提供[5],也是唯一一种可以穿过胎盘为胎儿提供被动免疫力的种型。 | |
| IgM | 1 | 五邊型 | 与B细胞表面结合的是单体形式,在分泌形态中则是由五個Y型單體排列而成的五聚体形式,具有极高的亲和力。又因其分子量極大,因此在抗原凝集反應中非常有效。在B细胞介导(体液)免疫的早期阶段IgG尚不充足,此时则主要由IgM来发挥清除病原的作用。同時為初次遭遇外來抗原後,最早回應出現的循環性抗體,但IgM在血液中的濃度会因清除作用迅速下降。因此,IgM通常可當做感染的指標。[5][15]。 |
种型
抗体可以根据其重链恆定區的不同而分為不同的种型,不同的种型在免疫系统中有不同的作用。对于胎生哺乳类动物,存在5种种型,分别是IgA、IgD、IgE、IgG以及IgM,其中前面的"Ig"代表免疫球蛋白(Immunoglobulin,对抗体的另一种称法)。这几种种型在生物中的属性、发挥功能的位置以及所能处理的抗原类型均有所不同,具体请参见右方的表格[17]。
B细胞的抗体种型会随着B细胞的发育和活化而有所变化。从未接触过任何抗原的未成熟B细胞(也称为初始B细胞或處女B细胞)仅在细胞表面表达IgM种型的膜结合形态。当其成熟后,将会同时表达IgM和IgD两种形式,这表明该B细胞已能够对抗原产生响应,亦即“成熟”了[18]。
透過株係選擇抗原与某一株B细胞上抗体的结合,将会导致該株係的B细胞活化,并随之分裂并分化成生产抗体的浆细胞(又稱效應B細胞、P細胞)及少量的記憶B細胞(Bm)。浆细胞这种活化形态的B细胞将会产生大量分泌形态的抗体,而不是膜结合形态的抗体。其中部分子代会发生免疫种型转换,该机制将会导致生产的抗体从IgM或IgD种型,变成IgE、IgA或者IgG种型。
结构
抗体是一种高分子球状血液蛋白质,重量约为150kDa。由于在部分氨基酸残基中含有糖链[19],抗体也是一种糖蛋白。能发挥功能的基本单位是一个免疫球蛋白单体。在分泌形态的抗体中包括:二聚体IgA、真骨附类鱼的四聚体IgM以及哺乳动物的五聚体IgM[20]。

可发生变化的部分称为V区(或变化区、可變區),而不变的部分称为C区(或恒定区)。
免疫球蛋白结构域
抗体的单体是一个Y形的分子,有4条多肽链组成。其中包括两条相同的重链,以及两条相同的轻链,之间由双硫键连接在一起[17]。每一条链均由称为免疫球蛋白结构域的多个结构域所组成。每一个结构域大约包含70至110个氨基酸,并根据大小和功能分门别类。例如可变域IgV以及恒定域IgC)[21]。它们的折叠方式很特别:通过两次β折叠将另一条链卷入其中形成三明治状,互相之间通过半胱氨酸和其它带电荷氨基酸紧密结合。
重链
哺乳动物的免疫球蛋白重链有5种,分别用希腊字母记为:α、δ、ε、γ以及μ[2]。根据重链类型的不同,抗体被分为不同的种型,它们被发现依序分别存在于抗体IgA、IgD、IgE、IgG以及IgM中[1]。不同的重链其大小和组成各不相同:α和γ大约有450个氨基酸组成,而μ和ε大约有550个氨基酸组成[2]。

2. 抗原结晶区(Fc)
3. 蓝色的重链有一个可变区(VH),紧随其后的一个恒定区(CH1),一个枢纽区,以及另两个恒定区(CH2 and CH3)组成
4. 绿色的轻链包含一个可变区(VL)以及一个恒定区(CL)
5. 抗原结合点
6. 枢纽区.
在鸟类的血液和蛋清中,还发现了被称为IgY的血清抗体种型。这种抗体种型和哺乳动物的IgG有很大的区别。然而在一些旧资料,甚至是生命科学商业产品的网站上,仍然称之为IgG。这是错误的,并且容易引起混淆。
每一条重链有两个区域:恒定区与可变区。同种型的抗体,其恒定区都是一样的,但不同种型之间该区域是不相同的。例如:γ、α以及δ型重链由三个免疫球蛋白结构域串联而成,并且还有一个用于增加弹性的铰链区;而μ及ε型重链则包括四个免疫球蛋白结构域[2]。不同B细胞所生产抗体的重链可变区是不同的,但是同一个B细胞及其克隆体所生产的不同种型抗体的可变区则是完全相同的。重链的可变区由一个结构域组成,包含大110个氨基酸。
轻链
免疫球蛋白轻链由大约211至217个氨基酸组成[2],分为两个结构域,分别是恒定区和可变区。哺乳动物的轻链有两种,分别命名为λ(lambda)和κ(kappa)[2]。每一个抗体的两个轻链的恒定區永远是完全相同的,例如对于哺乳动物而言,同一个抗体要么是λ型,要么是κ,不会同时存在。在如软骨鱼纲(鲨鱼)及真骨下纲的低级脊椎动物中,还可发现其它类型的轻链,如ι(iota)型。
CDRs、Fv、Fab以及Fc结构域
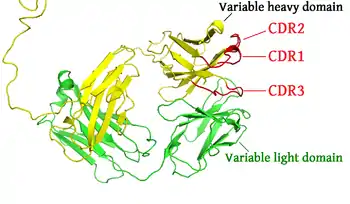
抗体的某些部分具有独特的功能。比如说Y形的臂区,包含了两个可以结合抗原的位点,是识别外来物的关键所在。该区域被称为Fab区,即抗原结合区段(fragment, antigen binding)。无论是重链还是轻链,抗原结合区段均包括一个可变区与一个恒定区[22],其中可变区的互补位成型于抗体单体氨基酸链的末端。可变区又被称为FV区,是与抗原结合的最关键区域,无论是轻链还是重链都包含该区域。实际上可变区的变化并非随机或者均匀散布的。更具体的说,这些变化分布在三个可变的β折叠-转角上,该区域被称为互补决定区(Complementarity Determining Region,CDR),也叫做高变区。乔西亚(Chothia)等人[23],以及后来的诺斯等人[24]对互补决定区的结构进行了归类。在免疫网络理论中,每个抗体的互补决定区又被称为独特型或者基因型。适应性免疫系统的适应过程,就是依靠有各个独特型之间的互动来进行调整的。
Y形结构的基座的作用是调节免疫细胞的活动,该区域被称为Fc区(Fragment crystallizable region,可结晶区域片段),由两条重链组成。根据抗体类型不同,该区域的每一条重链由2个或者3个恒定结构域组成[2]。因此,Fc区可通过与特定类型的Fc感受器,或者其它免疫分子如补体蛋白质相结合,来确保每个抗体可对一特定抗原产生一个正确的免疫应答。通过这一过程,可引发不同的生理学效果,包括识别调理颗粒、细胞溶解,以及肥大细胞、嗜碱性粒细胞和嗜酸性粒细胞的脱颗粒过程[17][25]。
功能
活化的B细胞可分化成两种不同用途的细胞:生产可溶性抗体的浆细胞,以及用于记忆已接触过的抗原的记忆B细胞。后者可在体内存活多年,并使得下次再接触到同样抗原时,能够更迅速的做出响应[26]。
胎儿和新生儿体内的抗体是由母亲所提供的,是一种被动免疫。在出生后一年内,新生儿就可自行产生许多不同的抗体。由于抗体可以溶解在血液当中,因此它们是体液免疫系统的一部分。体液循环中的抗体,是由应答某一特定抗原如病毒衣壳片段的B细胞克隆子代所产生的。抗体从下列三个方面为免疫力做出贡献:通过与病原体结合来避免入侵和破坏自身的细胞;通过刺激巨噬细胞等免疫细胞来包裹并清除病原体;以及通过刺激其它免疫应答过程如补体路径,来消灭病原体[27]。

补体的活化
当补体与细菌结合形成补体级联时,也是一种能和抗体结合的抗原。当抗体的Fv区与之结合时,会激活典型的补体系统[27]。这将会通过两种途径消灭该细菌[5]:第一种途径是通过抗体与补体的结合在微生物上作标记,使得噬菌細胞受到补体级联所产生的特定的补体的吸引,并通过一个叫做噬菌作用的过程吞噬细菌;第二种途径是通过形成一种叫做补体膜攻击复合物的补体抗体复合物来直接杀死细菌[28]。
效应细胞的活化(調理作用)
为了阻止病原体在细胞外进行复制,抗体通过与之结合而将其聚集在一起,即凝集。由于抗体至少拥有两个互不结合位,因此理论上它可以与不只一个相同类型的抗原相结合。通过对病原体的覆盖,抗体可以激活能识别该抗体Fc区的细胞的效应作用[5]。拥有可以识别覆盖病原体的抗体Fc区的细胞,可以和IgA、IgG以及IgE型抗体的Fc区发生互动。某一特定细胞上的Fc区感受器遇到特定的抗体后,会引发该细胞的效应作用,例如:吞噬细胞会进行吞噬,肥大细胞和中性粒细胞会脱颗粒,而自然杀伤细胞会释放细胞因子和细胞毒素等化学物质。这些作用最终会导致入侵微生物的解体。Fc区感受器是种型敏感的,因此可使得免疫系统具备更高的灵活性,当不同的病原体入侵时可以仅仅触发正确的免疫机制[2]。
凝集與沉澱反應
抗体上的抗原結合位可與抗原結合而将其聚集在一起,即凝集反應。由于抗体至少拥有两个抗原结合位,因此理论上它可以与不只一个相同类型的抗原相结合,使其抗原-抗體複合體更容易被吞噬細胞吞噬。若為可溶性抗原,則抗體能以形成抗原-抗體複合體的方式大大增加其分子量,使其溶解度降低而沉降於血管壁上,最後被吞噬細胞清除。
多样性
几乎所有的微生物都可以触发抗体的免疫应答。若想要成功识别并清除各种微生物,需要丰富多样的抗体,而这种多样性来自于抗体氨基酸的重组变化[31]。据估算,人类可以产生大约100亿种不同的抗体,每一种都可以与特定抗原的表位相结合[32]。尽管每个人可以产生的抗体是如此之多,但是产生这些蛋白质的相关基因却十分有限。脊椎动物发展出了一些复杂的基因机制,使得其B细胞可以利用有限的基因产生非常多样的抗体[33]。
结构域的可变性
染色体当中用于编码抗体的基因座范围很广,其中包含了编码各个结构域的基因。其中编码人类重链的基因座(IGH@)位于第14号染色体,而编码λ和κ型轻链的基因座(IGL@和IGK@)则位于第22号染色体和第2号染色体。重链和轻链中均存在的可变区,在不同的B细胞所产生的抗体中是不一样的。控制这些差异的三个转角被称为超变区(HV-1、HV-2及HV-3),又称为互补决定区(CDR1、CDR2及CDR3)。编码重链部分的基因座包含了65种不同的可变区基因,通过将这些基因与其它结构域的基因相组合,就可以产生高度差异的大量不同抗体,这一组合过程被称为V(D)J重组过程[34]。
V(D)J重组

体细胞的免疫球蛋白重组又被称为V(D)J重组,该过程可导致可变区发生独特的变化。免疫球蛋白中每一条重链和轻链的可变区是由若干个基因片段(亚基因)所编码的,这些片断分别被称为可变段(V)、多样段(D)以及连接段(J)[33]。这三种片段均存在于编码重链的基因片段中,而编码轻链的基因片段中只存在V和J段。在哺乳类动物的基因中,V、D和J段的重复基因序列串联在一起。骨髓中正在发育的B细胞,通过随机选择和组合V、D及J段各一段(轻链没有D段),来产生免疫蛋白的可变区。由于每段都有多个不同的拷贝,各段之间还存在不同的组合方式,因此抗体的可变区可以产生数量巨大的变化。正因有如此数量巨大的不同抗原结合位,所以可以产生对大量不同抗原具有特异性的抗体[8]。有趣的是,λ型轻链免疫球蛋白的某些亚基因(例如V2家族)的重排,和miR-650微RNA的活耦联,而后者则对B细胞的生化特性进一步发挥影响[35]。
在B细胞通过V(D)J重组过程产生了一个具备功能的免疫球蛋白之后,它就不可以再产生任何其它形状的可变区了,这一过程称为等位基因排斥。因此,每一个B细胞仅能产生某一种相同可变区的抗体[2][36]。
体细胞超突变与亲和力成熟过程
- 详细请参见:体细胞超突变与亲和力成熟过程
B细胞被抗原激活之后,将会迅速的增殖。在快速增殖的过程中,编码重链及轻链可变区的基因,会通过一种称为体细胞超突变过程,发生非常高概率的点突变。体细胞超突变会使得每一次细胞分裂,在基因的可变区中会产生大约一个核苷酸的变化[9]。这一过程将导致每一个子代B细胞会与亲代的DNA,在抗体氨基酸链的可变区部分产生细微的差异。
这种突变方式可以增加抗体池的多样性,并且对抗体与抗原的亲和力产生影响[37]。例如,突变的子代中,某些所产生的抗体与抗原结合的能力,比亲代所产生的抗体相比反而变弱了(亲和力下降),但另一些则可能变强了(亲和力增强)[38]。那些表达亲和力更强的抗体的B细胞,会在与免疫系统其它部分的交互过程中,获得比较弱者更强的生存信号,后者会逐渐因为凋亡作用而消失。这种使得生产的抗体逐渐增加结合亲和力的过程,就是亲和力成熟过程。亲和力成熟过程发生在已发生过V(D)J重组后的成熟B细胞上,并需要辅助T细胞的帮助[39]。
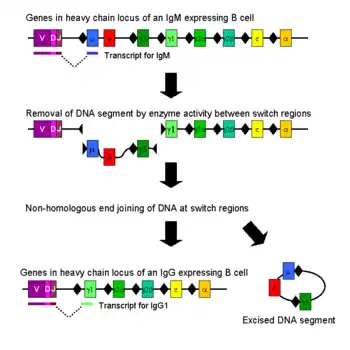
种型转换
免疫种型转换是在活化后的B细胞中发生的一个生物学过程,该过程使得细胞可以产生不同种型的抗体,如IgA、IgE及IgG等[8]。不同种型的抗体及其效应作用,是由免疫球蛋白重链中的恒定区决定的。最开始的时候,初始B细胞僅表达抗原结合区域相同的膜结合形态IgM和IgD抗体。而在活化之后,由于不同种型的抗体仅应对特定的功能,B细胞会根据清除抗原所需要的功能,选择生产具备IgG、IgA或者IgE效应作用的抗体。通过种型转换,从同一个活化B细胞分裂出来的子代细胞就可以生产不同种型的抗体。在种型转换的过程中,只有重链的恒定区发生了改变,而可变区则没有发生任何改变,因此所针对抗原的特异性也不会发生改变。因此,同一个B细胞的子代都能生产针对同一抗原的抗体,但却可以对各种抗原状况提供恰当的效应作用。生产哪一种型的抗体,是由B细胞所处环境中存在的细胞因子类型所决定的[40]。
生产抗体种型的转换,是通过一种称为种型转换重组(CSR)的机制对编码重链的基因座进行重组来完成的。该机制依赖被称为“交换区”的保守核苷酸模体,该模体存在于除δ链以外其它重链恒定区基因的上游DNA序列中。通过一系列酶的作用后DNA链的两个特定交换区被剪断[41][42],然后通过非同源性末端接合的过程,将可变区外显子与需要的恒定区如γ、α、ε链重新接合在一起。通过该过程,一段编码抗体的基因即可产生不同种型的抗体[43]。
相关疾病
尽管抗体是用于对抗外来异物的免疫手段,但在部分人群中却存在着因为抗体异常导致的自体免疫性疾病。这种问题主要是人体针对自身正常细胞或者化学产物的抗原,产生了对应的抗体而造成的。这些疾病当中相当大的一部分是由于自身免疫系统对这种自身抗体结合后的正常细胞产生免疫反应,进而导致杀伤自身细胞而造成的,例如,全身性红斑狼疮、干燥综合征、强直性脊柱炎以及类风湿性关节炎等。这一类的疾病性质根据不同的疾病,严重程度并不一样。如全身性红斑狼疮严重时可能会危及性命,而干燥综合征如果稍加控制,通常只会造成口感舌燥之类的不适。
除了主要因杀伤自身细胞导致的疾病外,还存在另一种致病的原因。例如,患者自身产生了针对促甲状腺激素受体的抗体,则可能发生如下两种情况:如果该抗体能够激活促甲状腺激素受体,则抗体和受体的结合也会产生类似促甲状腺激素的作用,并导致甲状腺当中的滤泡细胞分泌远超所需的甲状腺激素,于是导致弥漫性毒性甲状腺肿;而如果该抗体可以和受体结合,但不能激活该受体,即该抗体与受体的结合并不会刺激甲状腺分泌甲状腺激素,但由于促甲状腺激素因此被阻碍而无法与受体结合,于是导致甲状腺激素分泌量远少于自身所需,因此患者呈现甲状腺功能低下。
上面这类因自身基因异常所导致的免疫系统异常,尽管通常可以通过药物进行较为良好的控制,但一般不可能通过药物治疗根治。而对于某些非关键器官,例如甲状腺,可以通过手术摘除的方式根除疾病的病态反应。但术后需要长期服用相关药物以补充体内无法制造的物质,例如甲状腺激素等。
而另一种抗体相关的疾病则与“正常的”外来物有关。例如对于怀孕的妇女而言,其腹中胎儿,又或者进入妇女体内的男性精子等。这些外来物的抗原表位与患者自身的抗原表位并不相同,因此功能正常的免疫系统应当识别为外来物,并产生相应的抗体,最终通过免疫反应清除。然而这些外来物本来应该是正常生物活动中的一部分,如果被清除反而会导致不正常的后果。实际上正常的情况下,生物体内会有相应的机制抑制此类情况的发生。例如对于胎儿来说,胎盘除了会隔绝绝大部分的母体免疫细胞进入胎儿体内之外,还会产生相关的化学物质例如孕酮等,抑制免疫系统在胎盘附近的活性,从而避免对胎盘和胎儿造成伤害。但是在某些情况下,这种机制可能会遭到破坏,或者被绕过。例如在怀孕时,孕酮产量不足,导致胎盘被识别为外来物遭到破坏,导致早期胎停及流产。又或者在分娩甚至怀孕过程中,胎儿血液进入母体,或者母体免疫细胞进入胎儿导致母体产生对某种血型的抗体,进而导致下一次乃至本次怀孕因为胎儿血液中的红细胞被攻击溶解而流产。又或者因为生殖系统发炎,导致这些器官聚集了大量免疫细胞,于是进入体内的精子被识别成外来物的几率大幅提升,进而导致不孕。
和前一类疾病相比,这种疾病并不会因为抗体将自身正常细胞识别成外来物,而导致自身机能的失调,因此通常并不会直接导致危及性命。但由于正常的生理活动无法顺利进行,对于诸如生命延续这种重要的功能会遭受打击。同时可能因为早产等问题,严重威胁后代的性命。严重时甚至会因为流产等并发症,间接危及自身的性命。由于该问题通常并非自身基因导致的免疫系统故障所造成的,经由适当的治疗,甚至只需要一段时间不接触导致问题的抗原(例如精子),症状就会自行消失。同时,可以通过相关的筛查(例如夫妻血型对比),可以提前避免这类问题的出现。由于人体记忆B细胞的存在,一旦出现过这类症状,复发的可能性仍然是存在的。并且一旦复发,其反应时间会较初次更短,免疫反应也会更激烈。因此对于曾经出现该问题的患者,未来的相关活动都需要相对小心,尤其应当遵医嘱咐,使用适当药物来预防。
医学应用
疾病诊断及治疗
检测特定的抗体是一种常见的医学诊断方式,而血清学方面的应用便依赖于此[47]。以某种疾病的生化检查方法为例[47],可通过对血液中人類疱疹病毒第四型或者莱姆病抗体的滴定量来判断是否患病。如果被检测者的血液中没有发现这种抗体,则此人要么没有被感染,要么即使被感染也是很早以前的事情了——那些记忆B细胞都已消解殆尽了。在临床免疫学中,通过浊度测定法(或者比浊法)对各种免疫球蛋白的水平进行测定,以了解患者的抗体情况[48]。对于肝脏发生损伤但尚未确诊的患者检查何种免疫球蛋白升高情况,有的时候有助于找出问题的原因[1]。例如,IgA升高可能意味着酒精性肝硬化,IgM升高可能意味着病毒性肝炎或者原发性胆汁性肝硬化,IgG升高则可能是由肝硬化、病毒性肝炎或者自體免疫性肝炎的征兆。患有自體免疫性疾病的患者,通常会存在自身细胞抗原表位相结合的抗体,大部分患者可通过血液检查检测到。而通过抗体直接对红细胞的表面抗原进行抗人球蛋白测试,则可以确诊免疫所致的溶血性贫血[49]。抗人球蛋白测试也用于输血之前的抗体筛查准备工作,以及产前孕妇的抗体筛查[49]。在实践中,基于对抗原抗体复合物的免疫检测手段被用来诊断所感染的疾病,这些手段包括:酶联免疫吸附试验、免疫荧光染色法、西方墨点法、免疫扩散法、免疫电泳法以及磁性分离酶联免疫分析等。抗人绒毛膜促性腺激素抗体被用于非处方妊娠检测,如早孕试纸等。特定的单克隆抗体疗法被用于治疗诸如类风湿性关节炎[50]、多发性硬化症[51]、银屑病[52]等疾病。此外,单克隆抗体还被用于治疗诸如非霍奇金氏淋巴瘤[53]、大肠癌、头颈部癌以及乳腺癌等多种癌症[54]。某些如伴性遗传无丙种球蛋白血症以及低丙种球蛋白血症的免疫缺陷会导致部分甚至全部抗体的缺失[55]。这种类型的疾病,通常是通过向病患注射包含抗体的人或动物血清、混合免疫球蛋白或者单克隆抗体等方式,建立短期的被动免疫力的手段进行治疗的[56]。
产前治疗
Rh因子,又称为RhD抗原,是一种可存在于红细胞表面的抗原。Rh阳性(Rh+)的个体,其红细胞表面存在Rh抗原,而Rh阴性(Rh-)个体的红细胞表面则不存在这种抗原。正常的分娩过程,或者分娩创伤,或者怀孕过程中的并发症,都可能导致胎儿的血液进入母亲的免疫系统中。这种血液混合的情况,可能会导致Rh阴性的母亲,产生针对Rh阳性婴儿的血细胞抗原的抗体。这将导致剩下的孕期,以及未来的怀孕过程产生新生儿溶血症的风险[57]。
Rho(D)是对人类RhD抗原特异的抗体[58],是避免上述情形发生的产前治疗方案之一。对怀有RhD阳性胎儿的RhD阴性母亲来说,在接触到RhD抗原之前,或者至少在刚接触之时,通过给予RhD抗体的治疗方案是非常必要的。通过注射这种抗体,可以迅速有效地清除从胎儿血液中带来的包含RhD抗原表位的血细胞。这样可以避免刺激母亲的免疫系统产生能够生产RhD抗体的B细胞,尤其是记忆B细胞。因此,母亲的免疫系统就不会生产RhD抗体,也就不会攻击有RhD抗原的胎儿。尽管该治疗方案可以避免Rh血型新生儿溶血症的发生,但却不能治疗已经产生抗体所导致的情况[58]。
科研应用
通过向小鼠、大鼠或者兔身上注射特定的抗原,可以得到少量相应特异性的抗体。而如果需要得到大量的抗体,则需要向山羊、绵羊或者马身上注射相应的抗原。对这些实验动物的血液进行分离后,可以在血清中得到“多克隆抗体”。即,针对相同抗原的多种不同的抗体。这种方法制备的抗体又叫做抗血清。另一种制备抗体的方式是通过向受精蛋中注射抗原,然后从蛋清中获得抗体[59]。为了获得针对某一抗原单一抗原表位的特异性抗体,需要从动物身上分离出相应的抗体分泌淋巴细胞,然后通过与癌细胞株相融合使之可无限增值。这种融合细胞叫做杂交瘤,可以在培养环境中不停分泌抗体。通过稀释克隆法将单个杂交瘤细胞隔离出来,这种细胞克隆方法所制备出来的抗体是完全一样的,被称为单克隆抗体[60]。多克隆抗体和单克隆抗体的制备,通常还需要使用A/G蛋白质或者抗体亲和色谱法来进行提纯[61]。
在实验室中,纯化的单克隆抗体有许多应用场景。最常见的应用场景,是用来鉴定细胞内及细胞外的蛋白质类型。此外,不同类型的细胞会在细胞表面表达不同组合的分化簇分子,并生产出不同的胞内蛋白质,也会分泌出不同的蛋白质。因此单克隆抗体也被应用于流式细胞术中,通过识别不同细胞所表达的不同蛋白质来区分它们[62]。在免疫沉淀法中,也通过单克隆抗体来分离细胞溶解物中的特定蛋白及其结合物[63]。此外在西方墨点法中用来分析通过电泳法所分离出来的蛋白质[64],以及在免疫组织化学染色法或免疫荧光染色法中检验分析待检验组织中所表达的蛋白质,甚至通过显微镜直接观察蛋白质在细胞中的分布情况[62][65]。酶联免疫吸附试验(ELISA)及酶联免疫斑点(ELISPOT)等检测技术甚至可以通过单克隆抗体来对特定蛋白进行定量分析[66][67]。
结构预测
抗体对健康及生物技术工业的重要性导致了对其高分辨率结构的知识的需求。这些信息对蛋白质工程,修改抗体结合亲和性,以及识别特定抗体的抗原表位来说非常有用。X射线晶体学是其中一种研究抗体结构的常用手段,然而抗体的结晶过程非常耗时耗力。而通过计算机来研究晶体学问题,相对更快更便宜。但是计算机方法不能得出很确定的结论,因其不能产生经验所知的结构。诸如“网络抗体建模”(WAM)[68],以及“免疫球蛋白结构预测”(PIGS)[69]等在线服务器,使得人们能通过计算机对抗体可变区进行建模。“罗塞塔抗体”(Rosetta Antibody)是一个新型的FV区结构预测服务器,通过使用非常复杂的技术,它可以最大程度简化CDR转角过程,并优化轻重链相对位置的定位过程,还可以根据已知同源结构模型来预测抗原抗体是否能成功对接[70]。
历史
抗体(antibody)这个词首次出现在保罗·埃尔利希1891年10月公布的《免疫力的试验性研究》这篇文章中,德语的抗体“Antikörper”出现在该文章的结论部分。其中指出了“如果两种物质导致两种不同抗体的产生,那么这两种物质必然是不同的”[71]。然而这一术语并没有立即被接受,还有被建议使用的其它几个术语,如:免疫体(Immunkörper)、介体受体(Amboceptor)、介体(Zwischenkörper)、物质敏感体(substance sensibilisatrice)、连接体(copula)、德氏体(Desmon)、白细胞素(philocytase)、介体固定体(fixateur)以及免疫素(Immunisin)等[71][71]。抗体和抗毒素(Antitoxin)字面结构相似,概念则和免疫体(Immunkörper)类似[71]。
针对抗体的研究始于1890年,埃米尔·阿道夫·冯·贝林及北里柴三郎首次描述了抗体对白喉及破伤风痉挛毒素的抵抗作用。他们两人将体液免疫理论往前推进了一步,提出了血清中存在一种可以与外来抗原相反应的某种介质的假设[75][76]。保罗·埃尔利希受到了他们的这一想法的启发,于1897年提出了抗体与抗原互动的侧链理论假说。他假设道,在细胞的表面存在能和特定毒素发生一把钥匙对应一把锁类似的特异结合作用的感受器(原文为“侧链”),而结合反应则会进一步导致相关抗体的生产[77]。其他研究人员在之后的研究中认为,抗体可以在血液中稳定独立存在。在1904年,奥姆罗斯·莱特进一步提出通过可溶性抗体在细菌的表面包裹标识,使其成为吞噬作用的目标,并最终被消灭。这一过程被他命名为调理作用[78]。
到了二十世纪二十年代,迈克尔·海德堡和奥斯瓦尔德·埃弗里观察到抗原可以被抗体所凝结,并进一步发现抗体是一种蛋白质[79]。在三十年代,约翰·马拉克对抗原-抗体结合活动的生物化学性质做了更详尽的实验[80]。接下来的一次重大突破发生在四十年代,莱纳斯·鲍林通过抗体抗原的互动能力取决于各自的形状而不是其化学成分,证明了埃尔利希所提出的一把钥匙配一把锁的免疫学理论[81]。1948年,阿斯特丽德·法戈瑞奥司发现B细胞的其中一种形式浆细胞就是负责生产抗体的工厂[82]。
此后,研究工作的重点转向了识别抗体蛋白质结构中各部分的作用。二十世纪六十年代,杰拉尔德·埃德尔曼和约瑟夫·盖里发现了抗体的轻链[83],并且发现这和1845年由亨利·本册·琼斯所发现的本周氏蛋白质是同一种物质[84],这是一项重大的突破。紧接着,埃德尔曼在进一步发现抗体中的重链和轻链是由双硫键连接在一起的。与此同时,罗德尼·罗伯特·波特识别出了免疫球蛋白的抗体结合区(Fab)及抗体尾部的可结晶区[85]。根据这些发现,科学家们对免疫球蛋白的结构进行了推测,并描述了IgG蛋白质的完整氨基酸序列。以上这些发现,使得他们被共同授予1972年的诺贝尔生理学或医学奖[85]。Fv区则由戴维·吉沃尔(David Givol)所首先制备和识别[86]。正当人们对抗体的大多数早期研究还集中在IgM和IgG上时,六十年代还发生了重要的事情:托马斯·托马西发现了属于新种型的分泌形态IgA抗体[87],戴维·S·罗维和约翰·L·费伊则识别出了IgD[88],石坂公成和石坂照子夫妇则共同发现了与过敏反应有关的抗体种型IgE[89]。1976年,利根川进对免疫球蛋白相关基因进行研究,发现了抗体通过基因重排实现多样性的体细胞超突变基本原理[90]。
参考文献
- Rhoades RA, Pflanzer RG. 4th. Thomson Learning. 2002: 584. ISBN 0-534-42174-1.
- Janeway CA, Jr.等. 5th. Garland Publishing. 2001. ISBN 0-8153-3642-X. (electronic full text via NCBI Bookshelf).
- Litman GW, Rast JP, Shamblott MJ, Haire RN, Hulst M, Roess W, Litman RT, Hinds-Frey KR, Zilch A, Amemiya CT. . Mol. Biol. Evol. January 1993, 10 (1): 60–72. PMID 8450761.
- Maverakis E, Kim K, Shimoda M, Gershwin M, Patel F, Wilken R, Raychaudhuri S, Ruhaak LR, Lebrilla CB. . J Autoimmun. 2015, 57 (6): 1–13. PMID 25578468. doi:10.1016/j.jaut.2014.12.002.
- Pier GB, Lyczak JB, Wetzler LM. . ASM Press. 2004. ISBN 1-55581-246-5.
- Borghesi L, Milcarek C. . Immunol. Res. 2006, 36 (1-3): 27–32. PMID 17337763. doi:10.1385/IR:36:1:27.
- Parker D. . Annu Rev Immunol. 1993, 11 (1): 331–360. PMID 8476565. doi:10.1146/annurev.iy.11.040193.001555.
- Market E, Papavasiliou FN. . PLoS Biol. October 2003, 1 (1): E16. PMC 212695. PMID 14551913. doi:10.1371/journal.pbio.0000016.
- Diaz M, Casali P. . Curr Opin Immunol. 2002, 14 (2): 235–240. PMID 11869898. doi:10.1016/S0952-7915(02)00327-8.
- Parker D. . Annu. Rev. Immunol. 1993, 11 (1): 331–360. PMID 8476565. doi:10.1146/annurev.iy.11.040193.001555.
- Wintrobe, Maxwell Myer. . John G. Greer, John Foerster, John N Lukens, George M Rodgers, Frixos Paraskevas 11. Hagerstown, MD: Lippincott Williams & Wilkins. 2004: 453–456. ISBN 978-0-7817-3650-3.
- Tolar P, Sohn HW, Pierce SK. . Immunol. Rev. February 2008, 221 (1): 64–76. PMID 18275475. doi:10.1111/j.1600-065X.2008.00583.x.
- Wintrobe, Maxwell Myer. . John G. Greer, John Foerster, John N Lukens, George M Rodgers, Frixos Paraskevas 11. Hagerstown, MD: Lippincott Williams & Wilkins. 2004: 453–456. ISBN 0-7817-3650-1.
- Underdown B, Schiff J. . Annu Rev Immunol. 1986, 4 (1): 389–417. PMID 3518747. doi:10.1146/annurev.iy.04.040186.002133.
- Geisberger R, Lamers M, Achatz G. . Immunology. 2006, 118 (4): 429–437. PMC 1782314. PMID 16895553. doi:10.1111/j.1365-2567.2006.02386.x.
- Chen K, Xu W, Wilson M, He B, Miller NW, Bengtén E, Edholm ES, Santini PA, Rath P, Chiu A, Cattalini M, Litzman J, B Bussel J, Huang B, Meini A, Riesbeck K, Cunningham-Rundles C, Plebani A, Cerutti A. . Nature Immunology. 2009, 10 (8): 889–898. PMC 2785232. PMID 19561614. doi:10.1038/ni.1748.。
- Woof J, Burton D. . Nat Rev Immunol. 2004, 4 (2): 89–99. PMID 15040582. doi:10.1038/nri1266.
- Goding J. . Contemp Top Immunobiol. 1978, 8: 203–43. PMID 357078.
- Mattu T, Pleass R, Willis A, Kilian M, Wormald M, Lellouch A, Rudd P, Woof J, Dwek R. . J Biol Chem. 1998, 273 (4): 2260–2272. PMID 9442070. doi:10.1074/jbc.273.4.2260.
- Roux K. . Int Arch Allergy Immunol. 1999, 120 (2): 85–99. PMID 10545762. doi:10.1159/000024226.
- Barclay A. . Semin Immunol. 2003, 15 (4): 215–223. PMID 14690046. doi:10.1016/S1044-5323(03)00047-2.
- Putnam FW, Liu YS, Low TL. . J Biol Chem. 1979, 254 (8): 2865–74. PMID 107164.
- Al-Lazikani B, Lesk AM, Chothia C. . J Mol Biol. 1997, 273 (4): 927–948. PMID 9367782. doi:10.1006/jmbi.1997.1354.
- North B, Lehmann A, Dunbrack RL. . J Mol Biol. 2010, 406 (2): 228–256. PMC 3065967. PMID 21035459. doi:10.1016/j.jmb.2010.10.030.
- Heyman B. . Immunol Lett. 1996, 54 (2–3): 195–199. PMID 9052877. doi:10.1016/S0165-2478(96)02672-7.
- Borghesi L, Milcarek C. . Immunol Res. 2006, 36 (1–3): 27–32. PMID 17337763. doi:10.1385/IR:36:1:27.
- Ravetch J, Bolland S. . Annu Rev Immunol. 2001, 19 (1): 275–290. PMID 11244038. doi:10.1146/annurev.immunol.19.1.275.
- Rus H, Cudrici C, Niculescu F. . Immunol Res. 2005, 33 (2): 103–112. PMID 16234578. doi:10.1385/IR:33:2:103.
- Racaniello, Vincent. . Virology Blog. 2009-10-06 [2010-01-22]. (原始内容存档于2010-11-18).
- Milland J, Sandrin MS. . Tissue Antigens. December 2006, 68 (6): 459–466. PMID 17176435. doi:10.1111/j.1399-0039.2006.00721.x.
- Mian I, Bradwell A, Olson A. . J Mol Biol. 1991, 217 (1): 133–151. PMID 1988675. doi:10.1016/0022-2836(91)90617-F.
- Fanning LJ, Connor AM, Wu GE. . Clin. Immunol. Immunopathol. 1996, 79 (1): 1–14. PMID 8612345. doi:10.1006/clin.1996.0044.
- Nemazee D. . Nat Rev Immunol. 2006, 6 (10): 728–740. PMID 16998507. doi:10.1038/nri1939.
- Peter Parham. "The Immune System. 2nd ed. Garland Science: New York, 2005. pg.47-62
- Mraz, M.; Dolezalova, D.; Plevova, K.; Stano Kozubik, K.; Mayerova, V.; Cerna, K.; Musilova, K.; Tichy, B.; Pavlova, S. . Blood. 2012, 119 (9): 2110–2113. PMID 22234685. doi:10.1182/blood-2011-11-394874.
- Bergman Y, Cedar H. . Nat Rev Immunol. 2004, 4 (10): 753–761. PMID 15459667. doi:10.1038/nri1458.
- Honjo T, Habu S. . Annu Rev Biochem. 1985, 54 (1): 803–830. PMID 3927822. doi:10.1146/annurev.bi.54.070185.004103.
- Or-Guil M, Wittenbrink N, Weiser AA, Schuchhardt J. . Immunol. Rev. 2007, 216: 130–41. PMID 17367339. doi:10.1111/j.1600-065X.2007.00507.x.
- Neuberger M, Ehrenstein M, Rada C, Sale J, Batista F, Williams G, Milstein C. . Philos Trans R Soc Lond B Biol Sci. March 2000, 355 (1395): 357–360. PMC 1692737. PMID 10794054. doi:10.1098/rstb.2000.0573.
- Stavnezer J, Amemiya CT. . Semin. Immunol. 2004, 16 (4): 257–275. PMID 15522624. doi:10.1016/j.smim.2004.08.005.
- Durandy A. . Eur. J. Immunol. 2003, 33 (8): 2069–2073. PMID 12884279. doi:10.1002/eji.200324133.
- Casali P, Zan H. . Nat. Immunol. 2004, 5 (11): 1101–1103. PMID 15496946. doi:10.1038/ni1104-1101.
- Lieber MR, Yu K, Raghavan SC. . DNA Repair (Amst.). 2006, 5 (9–10): 1234–1245. PMID 16793349. doi:10.1016/j.dnarep.2006.05.013.
- 位于: Shoenfeld, Yehuda.; Meroni, Pier-Luigi.; Gershwin, M. Eric. . Amsterdam ; Boston: Elsevier. 2007. ISBN 978-0-444-52763-9.
- Farlex字典 > monovalent Citing: The American Heritage Science Dictionary, Copyright 2005
- Farlex字典 > polyvalent Citing: The American Heritage Medical Dictionary. 2004
- . Cellular Technology Ltd.—Europe. [2007-05-08]. (原始内容存档于2010-11-18).
- Stern P. (PDF). Klin Biochem Metab. 2006, 14 (3): 146–151 [2011-06-21]. (原始内容 (PDF)存档于2010-11-18).
- Dean, Laura. . . NCBI Bethesda (MD): National Library of Medicine (US),. 2005 [2011-06-21]. (原始内容存档于2006-09-02).
- Feldmann M, Maini R. . Annu Rev Immunol. 2001, 19 (1): 163–196. PMID 11244034. doi:10.1146/annurev.immunol.19.1.163.
- Doggrell S. . Expert Opin Pharmacother. 2003, 4 (6): 999–1001. PMID 12783595. doi:10.1517/14656566.4.6.999.
- Krueger G, Langley R, Leonardi C, Yeilding N, Guzzo C, Wang Y, Dooley L, Lebwohl M. . N Engl J Med. 2007, 356 (6): 580–592. PMID 17287478. doi:10.1056/NEJMoa062382.
- Plosker G, Figgitt D. . Drugs. 2003, 63 (8): 803–843. PMID 12662126. doi:10.2165/00003495-200363080-00005.
- Vogel C, Cobleigh M, Tripathy D, Gutheil J, Harris L, Fehrenbacher L, Slamon D, Murphy M, Novotny W, Burchmore M, Shak S, Stewart S. . Oncology. 61. 2001,. Suppl 2 (Suppl. 2): 37–42. PMID 11694786. doi:10.1159/000055400.
- LeBien TW. . Blood. 1 July 2000, 96 (1): 9–23 [2011-06-21]. PMID 10891425. (原始内容存档于2010-11-18).
- Ghaffer A. . Immunology - Chapter 14. University of South Carolina School of Medicine. 2006-03-26 [2007-06-06]. (原始内容存档于2010-11-18).
- Urbaniak S, Greiss M. . Blood Rev. 2000, 14 (1): 44–61. PMID 10805260. doi:10.1054/blre.1999.0123.
- Fung Kee Fung K, Eason E, Crane J, Armson A, De La Ronde S, Farine D, Keenan-Lindsay L, Leduc L, Reid G, Aerde J, Wilson R, Davies G, Désilets V, Summers A, Wyatt P, Young D. . J Obstet Gynaecol Can. 2003, 25 (9): 765–73. PMID 12970812.
- Tini M, Jewell UR, Camenisch G, Chilov D, Gassmann M. . Comp. Biochem. Physiol., Part a Mol. Integr. Physiol. 2002, 131 (3): 569–574. PMID 11867282. doi:10.1016/S1095-6433(01)00508-6.
- Cole SP, Campling BG, Atlaw T, Kozbor D, Roder JC. . Mol. Cell. Biochem. 1984, 62 (2): 109–20. PMID 6087121. doi:10.1007/BF00223301.
- Kabir S. . Immunol Invest. 2002, 31 (3–4): 263–278. PMID 12472184. doi:10.1081/IMM-120016245.
- Brehm-Stecher B, Johnson E. . Microbiol Mol Biol Rev. 2004, 68 (3): 538–559 [2011-06-21]. PMC 515252. PMID 15353569. doi:10.1128/MMBR.68.3.538-559.2004. (原始内容存档于2010-11-18).
- Williams N. . Methods Cell Biol. Methods in Cell Biology. 2000, 62: 449–453. ISBN 9780125441643. PMID 10503210. doi:10.1016/S0091-679X(08)61549-6.
- Kurien B, Scofield R. . Methods. 2006, 38 (4): 283–293. PMID 16483794. doi:10.1016/j.ymeth.2005.11.007.
- Scanziani E. . Methods Mol Biol. 1998, 104: 133–140. ISBN 978-0-89603-525-6. PMID 9711649. doi:10.1385/0-89603-525-5:133.
- Reen DJ. . Methods Mol Biol. 1994, 32: 461–466. ISBN 0-89603-268-X. PMID 7951745. doi:10.1385/0-89603-268-X:461.
- Kalyuzhny AE. . Methods Mol Biol. 2005, 302: 15–31. ISBN 1-59259-903-6. PMID 15937343. doi:10.1385/1-59259-903-6:015.
- Whitelegg N.R.J., Rees A.R. . Protein Engineering. 2000, 13 (12): 819–824 [2011-06-21]. PMID 11239080. doi:10.1093/protein/13.12.819. (原始内容存档于2010-11-18).
WAM Archived 2010-11-18 at WebCite - Marcatili P, Rosi A,Tramontano A. . Bioinformatics. 2008, 24 (17): 1953–1954 [2011-06-21]. PMID 18641403. doi:10.1093/bioinformatics/btn341. (原始内容存档于2010-11-18).
Prediction of Immunoglobulin Structure (PIGS) Archived 2010-11-18 at WebCite - Sivasubramanian A, Sircar A, Chaudhury S, Gray J J. . Proteins. 2009, 74 (2): 497–514 [2011-06-21]. PMC 2909601. PMID 19062174. doi:10.1002/prot.22309. (原始内容存档于2010-11-18).
RosettaAntibody 页面存档备份,存于 - Lindenmann, Jean. . Scand. J. Immunol. 1984, 19 (4): 281–5 [2008-11-01]. PMID 6374880. doi:10.1111/j.1365-3083.1984.tb00931.x. (原始内容存档于2010-11-18).
- Padlan, Eduardo. . Mol. Immunol. February 1994, 31 (3): 169–217. PMID 8114766. doi:10.1016/0161-5890(94)90001-9.
- . [2008-12-12]. (原始内容存档于2010-11-18).
- . [2008-12-12]. (原始内容存档于2010-11-18).
- . [2007-06-05]. (原始内容存档于2010-11-18).
- AGN. . Canadian Medical Association Journal. 1931, 25 (2): 206. PMC 382621. PMID 20318414.
- Winau F, Westphal O, Winau R. . Microbes Infect. 2004, 6 (8): 786–789. PMID 15207826. doi:10.1016/j.micinf.2004.04.003.
- Silverstein AM. . Nat. Immunol. 2003, 4 (5): 425–428. PMID 12719732. doi:10.1038/ni0503-425.
- Van Epps HL. (PDF). J. Exp. Med. 2006, 203 (1): 5 [2011-06-21]. PMC 2118068. PMID 16523537. doi:10.1084/jem.2031fta. (原始内容存档 (PDF)于2010-11-18).
- Marrack, JR. 2nd. London: His Majesty's Stationery Office. 1938. OCLC 3220539.
- . [2007-06-05]. (原始内容存档于2010-11-18).
- Silverstein AM. (PDF). Nat. Immunol. 2004, 5 (12): 1211–1217 [2011-06-21]. PMID 15549122. doi:10.1038/ni1140. (原始内容 (PDF)存档于2009-12-18).
- Edelman GM, Gally JA. . J. Exp. Med. 1962, 116 (2): 207–227. PMC 2137388. PMID 13889153. doi:10.1084/jem.116.2.207.
- Stevens FJ, Solomon A, Schiffer M. . Biochemistry. 1991, 30 (28): 6803–6805. PMID 2069946. doi:10.1021/bi00242a001.
- Raju TN. . Lancet. 1999, 354 (9183): 1040. PMID 10501404. doi:10.1016/S0140-6736(05)76658-7.
- Hochman J, Inbar D, Givol D. . Biochemistry. 1973, 12 (6): 1130–1135. PMID 4569769. doi:10.1021/bi00730a018.
- Tomasi TB. . Immunol. Today. 1992, 13 (10): 416–418. PMID 1343085. doi:10.1016/0167-5699(92)90093-M.
- Preud'homme JL, Petit I, Barra A, Morel F, Lecron JC, Lelièvre E. . Mol. Immunol. 2000, 37 (15): 871–887. PMID 11282392. doi:10.1016/S0161-5890(01)00006-2.
- Johansson SG. . Allergy and asthma proceedings : the official journal of regional and state allergy societies. 2006, 27 (2 Suppl 1): S3–6. PMID 16722325.
- Hozumi N, Tonegawa S. . Proc. Natl. Acad. Sci. U.S.A. 1976, 73 (10): 3628–3632. PMC 431171. PMID 824647. doi:10.1073/pnas.73.10.3628.
外部链接
| 维基共享资源中相关的多媒体资源:抗体 |
- 剑桥大学的 麦克的免疫球蛋白结构功能网页;
- 在蛋白质资料库中的 口腔蛋白质分子资料库中的抗体 页面存档备份,存于 讨论到抗体的结构;
- 南卡罗莱纳州立大学的 微生物及免疫学在线教材 页面存档备份,存于;
- 牛津大学的 近百年来的抗体治疗方案 页面存档备份,存于 论述了抗体在用于治疗疾病方面的历史和应用;
- “Cells Alive!”网站的 淋巴细胞是如何产生抗体的 页面存档备份,存于;
- 伯明翰大学的 抗体应用 页面存档备份,存于 中的荧光抗体图片库