磷脂双分子层
磷脂双分子层(英语:lipid bilayer 或phospholipid bilayer)是由两层磷脂分子组成的薄膜。 几乎所有细胞生物的细胞膜和许多病毒的包膜都主要由磷脂双分子层构成,此外,核被膜和许多胞器(如内质网等)也具有磷脂双分子层。 磷脂双分子层在细胞中起屏障作用,使离子、蛋白质或其它物质保留在需要之处,阻止其扩散到其他地方,并阻止有害物质的进入。 尽管厚度只有数纳米[1],磷脂双分子层能有效发挥屏障作用。大多数水溶性分子都不能透过磷脂双分子层。因此细胞可以通过离子泵在膜两侧转运离子,进而调节离子浓度或pH。
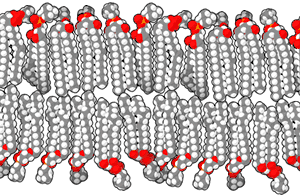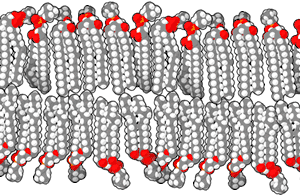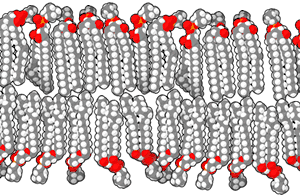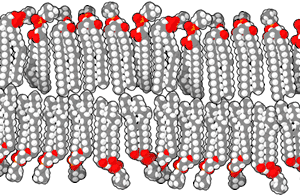
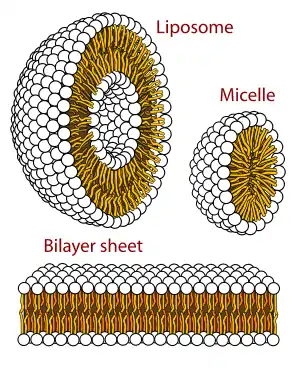
磷脂双分子层由具有两性的磷脂组成。磷脂分子具有亲水性的磷酸酯头部和由两个链状脂肪酸组成的疏水性尾部。 头部具有某些特定基团的磷脂可以改变双分子层表面的化学性质,并且具有特殊功能——例如信息传递或固定细胞膜中的其他分子[2]。与头部类似,尾部的脂肪酸也能影响膜的性质,例如影响双分子层的物相。双分子层在较低温度下为固体凝胶状态,而在温度升高后会变为液态。脂肪酸的化学性质影响该相变发生的温度。 脂质之间排列的紧密程度也影响其机械性能,例如抗拉伸性和弯曲性。现在已经能通过在实验室中人工制造磷脂双分子层模型来研究这些性质。由双分子层构成的囊泡也已在临床上用于传送药物分子。
自然中的生物膜通常会含有除磷脂外的其他分子。在动物细胞中,一个特别重要的例子就是胆固醇,能保持细胞膜的强度并减少其渗透性。胆固醇还能调节一些整合膜蛋白的活动。此外还有膜蛋白,参与许多细胞内和细胞间信号传导。由于磷脂双分子层非常脆弱且在传统光学显微镜中难以看到,对其进行研究颇具挑战;通常需要较为先进的技术,如电子显微镜和原子力显微镜。
组成与结构
磷脂被置于水中时会自动形成双分子层结构,疏水性烃基尾部位于内侧。因此双分子层由两个相对的脂单层组成。双分子层的中间几乎没有水,也不含溶于水中的糖类或离子。双分子层的形成由疏水效应驱动——疏水溶质进入水中会阻碍水分子间的相互作用,而疏水分子聚集后,水分子彼此能更自由地结合,自由、无序的水分子增加,进而系统的熵增加。这一复杂的过程主要涉及非共价作用力,例如范德华力和氢键。
截面
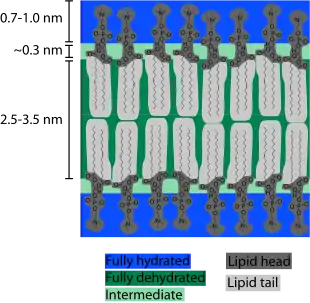
与其面积大小相比,磷脂双分子层非常薄。 如果一个典型的哺乳动物细胞(直径约10微米)被放大到西瓜的大小(约30厘米),则构成细胞膜的磷脂双分子层的厚度将仅仅与一张办公用纸相近。 尽管只有几纳米厚,但磷脂双分子层的横截面由几个不同的化学区域组成。在过去的几十年中,这些区域及其与周围水分子的不同相互作用已经通过X射线反射法[4]、中子散射法[5]和核磁共振法分辨被研究。
双分子层两侧的第一个区域是亲水性头部。该部分完全水合,通常约0.8-0.9nm厚。磷酸基团位于该水合区域内,在疏水性核心向外约0.5nm[6]。在某些情况下,水合区域可以进一步延伸,例如,磷酸酯头部附有大分子蛋白质或长链糖类时。一个常见的例子是细菌外层膜(outer membrane,在细胞膜之外)上的脂多糖层[7],有助于在细菌周围保留水层以防止脱水。
水合区域内侧是仅部分水合的中间区域。该边界层的厚度约为0.3nm。在这个较短的距离内,水的浓度从水合侧的2M下降到疏水侧的几乎为零[8][9]。中央疏水层通常为3-4nm厚,也会因链长和化学性质而有所变化[10]。疏水层厚度同时会随温度而显著变化,尤其是在相变温度附近[11]。
不对称性
对于许多天然存在的磷脂双分子层,两个脂单层的组成是不同的。在人类红细胞中,内侧的脂单层主要由磷脂酰乙醇胺、磷脂酰丝氨酸和磷脂酰肌醇及其磷酸化衍生物组成,外侧的脂单层由磷脂酰胆碱,鞘磷脂和各种糖脂[12][13]。 在某些情况下,这种不对称性基于脂质在细胞中的形成位置,并反映它们的初始方向 [14]。双分子层不对称的生物学功能尚未为人完全所知,但现在已经清楚的的是,其主要用于几种不同的情况。 例如,当细胞凋亡时,通常会位于内侧脂单层的磷脂酰丝氨酸被转移到外侧,并被巨噬细胞识别,然后巨噬细胞主动清除凋亡的细胞。
双分子层的不对称性至少部分地来源于其形成的方式——大多数磷脂被合成时最初置入内侧单层,而构成外侧单层的通过翻转酶从内单层转运而来[15][16];其他脂质,例如鞘磷脂,则是直接在外侧单层合成的。翻转酶是脂质转运分子的一种,其中还包括向相反方向转移脂质的翻转酶和能使两侧的脂质分布随机化(凋亡细胞会发生这样的过程)的磷脂混杂酶。不对称性一旦建立,通常不会在短暂时间内消失,因为脂单层间脂质的自发相互转移极其缓慢[17]。
现已可以在实验室中的人造双分子层系统中模拟这种不对称性。某些非常小的人工囊泡会自动产生略微的不对称性,但产生这种不对称性的机制与细胞中的非常不同[18]。通过在Langmuir-Blodgett沉积法中使用两种不同的单层[19]或用Langmuir-Blodgett和囊泡破裂沉积的组合[20]也可以合成不对称的平面双层。随着时间的推移,这种不对称性可能会消失,因为固定面支撑的双分子层(SLB)中的脂质可能易于发生单层间相互转移[21]。
物相和相变
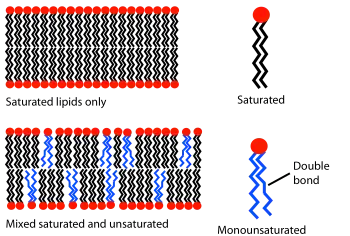
在给定温度下,脂质双层可以以液体或凝胶(固体)相存在。所有脂质都具有一特征温度,在该温度下它们从凝胶相转变为液相。在这两个相中,脂质分子都难以在兩個单层间相互转移,但是在液相双层中,特定的脂质将与同一单层内其它脂质分子交换位置,频率会高达每秒数百万次。这种随机的交换会使脂质扩散并因此在膜表面上转移[22]。与液相不同,凝胶相中的脂质具有较低的迁移率。
脂质双分子层的状态主要由相邻脂质分子之间吸引的范德华力的强度决定。较长的烃基具有更多的相互作用区域,相互作用更强,则脂质的流动性更低。因此,在一定温度下,短尾脂质将比其他条件相同的长尾脂质流动性更强[10]。相变温度也受烃基不饱和度的影响。不饱和的双键可在烷烃之间产生扭结的链,破坏脂质分子的紧密排列,产生额外的空间,增加相邻分子间的灵活性[10]。这种效应在日常生活中的一个例子是,含有大量饱和脂肪的黄油在室温下是固体,而主要是不饱和的植物油是液体。
大多数天然的生物膜是不同种类脂质分子的复杂混合物。如果某些组分在给定温度下是液体,而其他一些组分处于凝胶相,则这两个相可以各自处于分离区域中,彼此共存——有些像漂浮在海洋中的冰山。这在生理过程中发挥着关键作用,因为蛋白质等膜组分可以单独处于一个或另一个相[23],从而局部浓缩或活化。许多混合相生物膜的一个特别重要的组分是胆固醇,其能调节双分子层的渗透性、机械强度和生化反应。
表面化学
脂质尾部的烃基主要调节双分子层的相态,而头部基团决定其表面化学性质。自然中大多数双分子层主要由磷脂组成,但鞘脂和胆固醇之类的甾醇通常也是重要的组分[24]。在磷脂中,最常见的头基种类是磷脂酰胆碱(PC),占大多数哺乳动物细胞中磷脂的约一半。磷脂酰胆碱的头基是两性离子——其磷酸基团带负电荷,而胺基上带正电荷。但这些局部电荷保持平衡,因而整体不带电荷。
其他头部基团包括磷脂酰丝氨酸(PS)磷脂酰乙醇胺(PE)和磷脂酰甘油(PG)。这些头部基团通常使双分子层具有一些特定生物学功能,例如,在细胞膜外侧存在磷脂酰丝氨酸是红血球细胞凋亡的标志[25],而骺板处的磷脂酰丝氨酸则对羟磷灰石晶体的成核和随后的骨矿化很有必要[26][27]。与磷脂酰胆碱不同,一些其他头基带有净电荷,能改变双分子层与其他小分子间的静电相互作用[28]。
生物学作用
分隔作用
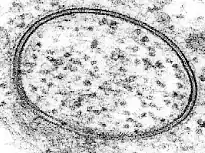
磷脂双分子层在生物体中最主要的作用是将一部分水溶液与其周围环境分隔开。如果没有能分隔“自身”与“异己”的屏障,甚至有机体和生命的概念都很难定义。目前已知的所有生命形式都以磷脂双分子层作为其与外界的屏障,除了细胞膜为脂单层的少数古细菌外。甚至有理论认为,最初的生命形式可能是一种简单的脂质囊泡,其唯一的生物合成是产生更多的磷脂[29]。磷脂双分子层有分隔能力,是因为亲水性分子难以穿过具有疏水性的中心部分(参见下文穿膜运输部分)。细胞核、线粒体和叶绿体都有两层磷脂双分子层,而其他一些亚细胞结构(例如液泡、内质网、高尔基体和溶酶体)则由单层包围[30]。(详见细胞器)
原核生物一般只有一个磷脂双分子层——细胞膜(也称为质膜)。许多原核生物也具有细胞壁,但细胞壁是由蛋白质或碳水化合物组成。相比之下,真核生物具有多种细胞器,包括线粒体、溶酶体和内质网。所有这些亚细胞结构都被一个或多个磷脂双分子层包围。因此,一般情况下,这些细胞内部的亚细胞结构才构成了细胞大多数的磷脂双分子层,而非外部的细胞膜。例如,在肝细胞中,细胞膜仅占细胞总磷脂双分子层面积的2%,而线粒体30%,内质网超过50%[31]。
信息传递
突触传递可能是最广为人知的细胞信号传导形式,神经冲动到达一个神经元末端後,通过神经递质的释放传递给相邻的神经元。这种信息传导依赖能够运载神经递质的突触小泡。这些囊泡与突触前膜(实为第一个神经元的细胞膜)融合,并将其内容物释放到突触间隙,然后通过扩散到达突触后膜。然而,到达突触后膜后,神经递质也要依靠细胞膜的信息传递功能来发挥作用。
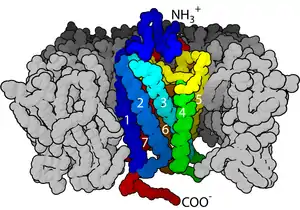
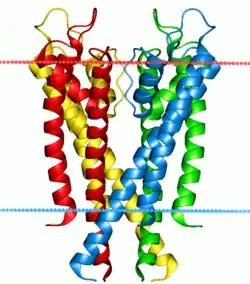
磷脂双分子层依靠附着其上的膜蛋白而参与信息传递。膜蛋白是一类非常广泛且重要的生物分子——据估计,人类蛋白质组中可能有多达三分之一的膜蛋白[32]。这些蛋白质中,一些附在细胞膜的表面,例如CD59蛋白,它使细胞被识别为“自身”,从而防止其被免疫系统破坏。HIV能逃避人的免疫系统,部分是依靠从宿主细胞膜中转移这类蛋白质到其自身表面[31];此外,还有一些膜蛋白贯穿双分子层,并用于将信息从一侧传递到另一侧。这类蛋白质中最常见的是G蛋白偶联受体(GPCR)。细胞与外界信息交流的功能很多都依靠GPCR。由于这一重要作用,大约40%的现代药物都是针对GPCR的[33]。
除由蛋白质或溶液介导外,磷脂双分子层还可能直接参与信息传递。一个典型的例子是磷脂酰丝氨酸触发的吞噬作用。通常,磷脂酰丝氨酸在细胞膜中不对称分布,仅存在于内侧。在细胞凋亡期间,磷脂混杂酶使其分布平均,因此在细胞膜外侧也出现磷脂酰丝氨酸。然后磷脂酰丝氨酸在外侧的存在引发吞噬作用,以清除衰老或死亡的细胞。
研究方法
磷脂双分子层是一种非常难以研究的结构,因为它非常薄且易碎。尽管存在这些限制,在过去几十年中已经开发了许多技术以对其结构和功能进行研究。
电测量是一个简单电测量是研究磷脂双分子层一个重要功能的直接方式——分隔并阻止溶液中的离子自由流动。通过在双分子层上施加电压并测量所得电流,可以得到双层的电阻。这种电阻通常非常高(108 Ω/cm2 或更多) [34],因为疏水核心对带电的离子是不可渗透的。即使是几纳米大小的孔也会导致电流急剧增加[35]。这种测量方法的灵敏度较高,甚至可以分辨出单个离子通道的活动[36]。
电测量不能提供像显微镜成像那样的实际图像。因为太薄,传统显微镜无法观察到双分子层。为了对其进行观察,研究人员经常使用荧光显微镜,用特定波长的光照射样品,并观察样品发出的更长波长的光。自然状态下磷脂双分子层没有荧光性,须用能附着在双分子层中分子上的荧光染料。荧光显微镜的分辨率通常限于几百纳米,比典型的细胞小得多,但仍远大于脂质双层的厚度。
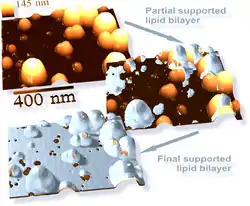
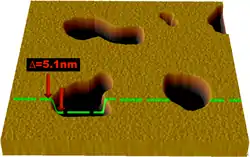
电子显微镜能提供更高分辨率的图像。在电子显微镜中,电子束“照射”样品,而不是传统显微镜中的光束,因而有更高的分辨率。结合快速冷冻技术,电子显微镜也被用于研究细胞间和细胞内物质运输的机制,例如证明突触中神经递质释放的方式是胞吐。[38]
31P-NMR(核磁共振)谱也被广泛用于自然条件下磷脂双分子层和生物膜的研究。[39]对31P-NMR谱的分析可以提供关于磷脂双分子层的很多信息,包括分子组成、相变(凝胶相、液晶相、波纹相,非双层相)、头部基团的结构取向,以及弹性(弹性既来源于双分子层本身,也依靠附着其上的蛋白质或其他分子)。
一种研究磷脂双分子层的新方法是原子力显微镜(AFM)。AFM不使用光束或粒子束,而是用一个非常小的探针尖端与样品物理接触并在其上移动来扫描表面(类似于唱片机针)。AFM是一种很有前途的技术,因为其有可能在室温下甚至在水或缓冲溶液(自然条件下双分子层正常工作所需的条件)条件下以纳米级分辨率成像。利用这种功能,AFM已被用于检查动态双层行为,包括跨膜孔洞的形成[37]和支撑磷脂双层的相变[40]。另一个优点是,由于探针尖端与样品直接机械相互作用,AFM不需要荧光染料或同位素标记。因此,可以同时对脂质和相关蛋白质进行成像,甚至能达到单分子分辨率[41]。AFM还可以探测脂双层膜的机械性质[42]。
磷脂双分子层表现出高水平的双折射,其中水平方向与垂直方向上的折射率差达到0.1。这已被用于使用双极化干涉测量法来研究磷脂双分子层的有序或无序程度,并理解蛋白质的作用机制。
磷脂双分子层是具有许多自由度的复杂分子系统。因此,对其从分子上进行模拟,特别是对其性质从头计算将是十分困难的并且成本昂贵。最近,已经成功进行估计双分子层偶极和四极矩的量子计算[43]。
跨双层运输
自由扩散
大多数极性分子在磷脂双分子层由烃基组成的中心部分具有较低的溶解度,因此极性分子对于整个双分子层的渗透系数较低。这种效应对于带电离子尤其明显,带电离子的渗透系数甚至低于中性极性分子[44]。 阴离子通常具有比阳离子更高的扩散速率[45][46]。与离子相比,水分子的渗透性实际上较强,渗透现象能证明这一点:当将具有较低水含量(较高渗透压)的细胞或囊泡置于具有较高水含量(较低浓度)的溶液中时,细胞将膨胀并最终破裂。除非水能够相对容易地通过双分子层,否则将不会观察到这样的结果。磷脂双分子层对于水异常大的渗透性仍未被完全理解,并且仍然有很多争议[47]。较小且不带电荷的非极性分子能通过自由扩散通过双分子层,速度比离子或水快多个数量级。这适用于脂肪和氯仿、乙醚之类的有机溶剂。对于极性和非极性物质,较大的分子的扩散速率都比小分子更慢[48]。
离子泵和离子通道
为了跨膜运输难以渗透的离子,磷脂双分子层上有两种的蛋白质——离子泵和离子通道。这两类蛋白质都是跨过双分子层的整合性膜蛋白,但它们的功能有所区别。离子泵能利用外部能量逆浓度梯度(运输到化学势更高的一侧)运输离子,以构建或维持浓度梯度或电位梯度。能量来源可以是ATP(例如钠钾泵),或是已经存在的另一种浓度梯度,如钠钙交换蛋白(NCX),利用钠离子顺浓度梯度运输的能量逆浓度梯度运输钙离子。通过离子泵的作用,细胞能运输质子以调节pH。
与离子泵相比,离子通道不能产生浓度梯度,而只能使离子顺浓度梯度运输,减小浓度梯度。常见的例子是钠离子通道,对于神经元上动作电位的产生十分重要。所有离子通道都有某种触发机制,可能是因电压变化而激活 ,也可以通过结合配体或通过另一种附近蛋白质的构象变化来激活[49]。
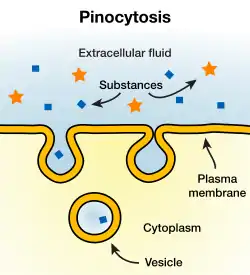
胞吞和胞吐
如果遇到分子或其他颗粒太大或亲水性太强而不能通过双分子层,或分子可以通过双分子层,但必须快速大量运输,以至于离子通道不能满足需求的情况,这些物质可以通过囊泡的融合或形成通过双分子层。当在细胞内产生囊泡并与细胞膜融合,以将其内容物释放到细胞外部时,该过程称为胞吐;与之相反,细胞膜的一个区域内凹陷并最终断开,形成囊泡,包含部分细胞外液并将其输送到细胞中,这一过程称为胞吞。胞吞和胞吐作用依赖的分子机制不同,但这两个过程又密切相关,不能分离。不能分离的原因在于生物膜的脂质含量需要维持相对恒定,才能正常发挥作用[50]。 在一个典型的细胞中,每大约半小时,胞吞、胞吐形成的囊泡总表面积就与整个细胞膜相当[51]。因此,如果这两个过程没有相互平衡,那么细胞将向外膨胀至无法正常发挥作用的大小,或在几分钟内耗尽其细胞膜。
原核生物中的胞吐作用:囊泡运输系统因2013年诺贝尔奖而广为人知。囊泡运输传统上被认为是真核细胞的特权[52],而现在,这一论断已经被打破,因为现已发现革兰氏阴性菌能释放外膜囊泡将细菌信号分子转移到宿主或靶细胞上[53],以实现某些功能,例如入侵宿主细胞[54]或微生物 - 环境相互作用[55]。
电穿孔
电穿孔是通过在膜上施加较大的人工电场,使磷脂双分子层的渗透性迅速增加。在实验中,这一技术常被用于将亲水性分子导入细胞中。此外,对于较大又带较多电荷的分子(如DNA),电穿孔技术也非常有用,因为一般情况下这样的分子基本上不可能扩散穿过双分子层[56]。因此,电穿孔是转染和细菌转化的关键方法之一。甚至有理论认为,雷击引起的电穿孔可能是自然条件下基因转移的机制[57]。
渗透率的这种增加主要影响离子和其他水合物质的运输,这表明该现象的机制是在膜中产生纳米尺度的充水孔。尽管电穿孔和电击穿都是由施加电场引起的,但所涉及的机理基是本质不同的。在电击穿中,电介质被电离,形成导电通路。因此,材料发生化学变化。相反,在电穿孔中,脂质分子没有发生化学变化,而只是改变位置产生孔洞,填充孔洞的水成为双分子层的导电通路。
机械性能

磷脂双分子层有足够大的结构,具有液体或固体的一些机械性质。可以用面积拉伸模量Ka、弯曲模量Kb、临界能量来描述其力学性质。固相的磷脂双分子层也具有剪切模量,而液相时其剪切模量为零。这些机械性能影响膜的功能。例如,Ka和Kb影响蛋白质和小分子插入双分子层的能力[58][59]。此外,机械性能也已被证明可以改变离子通道的功能[60]。机械性能也决定了细胞在没有撕裂的情况下可以承受的应力。尽管磷脂双分子层很容易弯曲,但大多数不能拉伸超过百分之几,否则会撕裂[61]。
正如在组成与结构部分中所讨论的,烃基尾部在水中的疏水性吸引力是将脂质双层保持在一起的主要力。因此,双分子层的弹性模量主要取决于当双分子层被拉伸时,有多少区域暴露于水中[62]。因此就不难理解Ka随渗透压变化较大[63],而与烃基长度或不饱和度关系较小[10]的实验结果。因为所涉及的力很小,难以通过实验确定Ka。大多数实验需要复杂的显微镜和非常灵敏的测量设备[42][64]。
拉伸模量 Ka 衡量拉伸双分子层所需的能量,而弯曲模量Kb衡量弯曲双分子层所需的能量。弯曲模量衡量使膜从其固有曲率变形到另一曲率所需的能量。固有曲率由构成双分子层分子头部基团的直径与尾部基团的直径的比例决定——对于头部基团为磷脂酰胆碱,有两个烃基的磷脂分子,该比值接近1,因此固有曲率几乎为零(层状结构)。如果一种脂质的固有曲率与零相差较大,则该种脂质难以形成层状结构,而是形成其他相,例如胶束或反胶束。在富含半乳糖脂的类囊体薄膜中添加较小的亲水性分子(如蔗糖),会打破双分子层的稳定性,变为胶束相[65]。一般情况下 Kb 并非由实验测定,而是由 Ka 和双分子层厚度计算得到。
衡量破坏双层,使之形成孔洞或暴露的边缘所需的能量。形成孔洞或边缘会使部分脂质暴露于水中,更不稳定,因而这一过程需要消耗能量。然而,边缘处脂质的确切方向是未知的,如图所示。有证据表明,疏水性和亲水性孔隙(见图)可以共存[66]。
融合
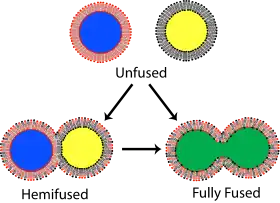
融合是两个磷脂双分子层合并,形成连接结构的过程。两个脂单层都合并为全融合。如果原本双分子层形成了囊泡,则其包含的溶液也会混合;只有一个脂单层融合则称为半融合。许多生理过程都依赖双分子层的融合,特别是在真核生物中,因为真核细胞包含多种膜结构。胞吐、精卵结合或溶酶体的消化作用依靠双分子层的融合。甚至部分病原体侵入细胞也依靠融合,例如许多包膜病毒。
融合过程有四个基本步骤[67]。首先,两个双分子层必须彼此接近,到距离仅为几纳米。之后,将要融合的部位更加紧密地接触(距离在几埃之内)。为了实现这种紧密接触,两个表面必须至少部分脱水,因为表面结合的水导致双层之间强烈排斥。离子,尤其是二价阳离子(如Mg2+和Ca2+)对该过程有较大影响[68][69]。钙离子在生物体内的关键作用之一就是调节膜融合。第三,两个双分子层之间的某一点形成不稳定,局部扭曲的结构。这种扭曲结构的具体性质尚不明确。一种理论认为双分子层中必须形成高度弯曲的通道才能融合[70]。该理论的支持者认为,这种理论能解释磷脂酰乙醇胺(一种高度弯曲的脂质)能促进融合的原因[71]。最后,融合的区域不断扩大,最终完成融合。
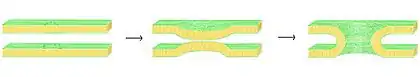
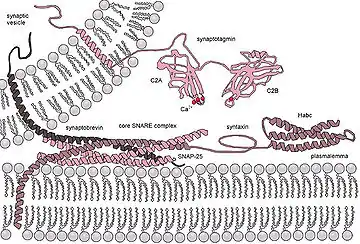
真实生物体内磷脂双分子层的融合更加复杂,因为生物膜融合几乎都受到相关蛋白质的调节。例如病毒融合蛋白,其允许包膜病毒(由磷脂双分子层包围的病毒;一般病毒仅具有蛋白质外壳)将其衣壳和基因组插入宿主细胞中。真核细胞也具有融合蛋白,其中包括目前已被深入研究的SNARE蛋白。SNARE蛋白用于调节囊泡在细胞内的运输。尽管经过多年的研究,关于这类蛋白质的功能还有很多未知之初。即使是SNARE蛋白,对于其发挥作用的阶段是两层膜的早期对接,还是随后的半融合阶段依然存在争议[73]。
在分子和细胞生物学的研究中,通常需要人工诱导膜融合。其中一种方法是加入聚乙二醇(PEG)诱导融合。这种方法被广泛使用,例如用于将B淋巴细胞与骨髓瘤细胞融合[74],形成具有B细胞合成抗体功能,又具有肿瘤细胞无限增殖特性的杂交瘤细胞;此外,用电激法也可以诱导融合。这种方法的原理就是上文提到的电穿孔现象。电穿孔会在双分子层上形成有活性边缘的孔洞,可以在两个双层之间形成通道[75]。
人造双分子层
天然生物膜难以分离与纯化,因此实验中常使用人造的磷脂双分子层。此外,人造双分子层还被用于合成生物学,作为人造细胞的膜。人造双分子层分为很多种,有的由人工合成,也有的由天然脂质制成。在实验中它们各有优点和缺点。最常见的人造双分子层系统包括:
- 支撑磷脂双层(SLB)
- 锚定磷脂双层(t-BLM)
- 囊泡
- 液滴界面双层(DIBs)
应用
迄今为止,磷脂双分子层最成功的应用是将脂质体(脂质体实质上与 囊泡同义,但脂质体仅指人工而非天然囊泡)用于药物传递,尤其是用于癌症治疗。脂质体用于传递药物的基本操作是将药物(通常为溶液)包裹于脂质体内,然后注射到患者体内。这些装载药物的脂质体能在体内运输而保持稳定,直到与靶向位点结合并释放药物。理论上,脂质体能成为理想的药物传递载体,因其可以分离几乎任何亲水性药物,且可以连接其他分子(如糖蛋白)以靶向特定组织或细胞,此外,生物体具有降解脂质的能力,因此脂质体是相对无毒的。[76]
最初的用于药物传递的脂质体仅由简单的脂质组成,具有若干局限性——由于被肾脏清除或被免疫细胞吞噬,能够在血流中循环的脂质体非常有限。通过调节脂质组成来改变脂质体的流动性、表面电荷密度和表面水合性质能使其从血清中吸附较少的蛋白质,因此不易被免疫系统识别[77]。该领域最重要的进展是将聚乙二醇(PEG)接到脂质体表面,以产生“隐形”脂质体,其长时间循环而没有被免疫系统或肾脏清除[78]。
“隐形”脂质体的最初应用是靶向肿瘤组织。因为肿瘤诱导快速和不受控制的血管生成,所以其使得脂质体以比正常组织高得多的速率离开血流[79]。目前已进行将抗体或其它分子标记到脂质体表面,使其与特定的细胞或组织结合的研究[80],一些实例已经进入临床实验阶段[81]。
磷脂双分子层的另一个潜在应用是生物传感器领域。磷脂双分子层依靠其上的其他分子承担许多信号转导功能。多年来,研究人员一直试图利用这种潜力开发出一种能用于例如临床诊断或生物恐怖主义检测等情况的设备。该领域目前进展缓慢,尽管已有少数公司已开发出基于双分子层的自动检测系统,但这些设备的受众仍然局限于研究领域,而非日常生活。其中包括 Biacore(现为GE Healthcare Life Sciences),该公司提供一种一次性芯片,能够用于结合动力学研究中[82];此外,Nanion Inc. 开发了一种自动膜片钳系统[83]。 其他更奇特的应用也在试验中,例如使用磷脂双分子层孔用于DNA测序。迄今为止,该技术尚未证明具有商业可行性。
用支撑磷脂双层(SLB)测量药物渗透性的方法——平行人工膜渗透模型(PAMPA)技术也已经获得了商业应用。该技术使用一种混合脂质构成的膜来测量药物渗透性。通过调整不同的脂质组成,PAMPA技术可以实现多个模型,包括Caco-2细胞模型[84][85]、胃肠道模型[86]、血脑屏障模型[87]和皮肤模型[88]。
历史
在二十世纪初,科学家开始相信细胞周围存在薄的油性屏障[89], 但对这种膜的结构性质尚不清楚。1925年的两次实验奠定了对这一“屏障”研究的基础:通过测量红细胞溶液的电容,雨果·弗里克(Hugo Fricke)确定细胞周围膜的厚度约为3.3纳米[90]。
尽管该实验的结果是准确的,但弗里克认为细胞膜是单个分子层。莱顿大学的两名荷兰科学家高特(E. Gorter, 1881–1954)[91]和格兰戴尔(F. Grendel)从另一个角度解决了这一问题:他们提取红细胞中的脂质(红细胞没有细胞器,因此所有脂质都来自于细胞膜),并形成Langmuir-Blodgett膜(单分子厚度)。数据表明该单分子膜的表面积与细胞膜面积的比例为2:1[92]。 后来的研究表明,这个实验实际上有一些错误,实验基于的假设也不尽正确。但是,也许是偶然的原因,这些错误没有在实验结果中显现出来,而从这个实际上有缺陷的数据中,Gorter和Grendel得出了正确的结论——细胞膜是双层膜[67]。
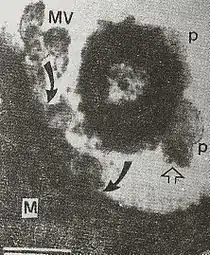
这一理论直到20世纪50年代后期才通过电子显微镜观察得到了证实,研究者罗伯特森(J.D.Robertson)没有发表这一世界上首次对磷脂双分子层的电子显微镜研究[93]。电子显微镜图片中的细胞膜出现暗-亮-暗结构(见“研究方法”部分中囊泡的图片),罗伯特森认为,两个较暗的电子密集带是两个相对的脂单层的头部基团和蛋白质[94][95]。这一理论被称为单位膜模型,是第一个试图统一细胞膜和其它生物膜结构的理论。
大约在同一时间,人造双分子层的发展证实完全由脂质构成的双分子层也是一种稳定的结构,可以独立于蛋白质而存在。Paul Mueller 和 Donald O. Rudin 通过在疏水性材料上做出小孔,之后向小孔注射磷脂在有机溶剂中的溶液,制作出了人造双分子层。实验表明,该人造双分子层表现出横向流动性。高电阻和对穿刺的自我修复能力[96],而这些同时也是天然生物膜的性质。数年后,亚力克·邦汉姆(Alec Bangham)发现,脂质体(空心球状的磷脂双分子层)可以简单地通过将干燥的脂质置于于水中而形成[97]。这是一个重要的发现,因为其证明磷脂双分子层可以通过自组装自发形成,而不需要经由外部力量有意识的组装而成。这一过程可能与最初生命的形成有关。
参考文献
- Andersen, Olaf S.; Koeppe, II, Roger E. . Annual Review of Biophysics and Biomolecular Structure. June 2007, 36 (1): 107–130 [12 December 2014]. doi:10.1146/annurev.biophys.36.040306.132643. (原始内容存档于2019-08-09).
- Divecha, Nullin; Irvine, Robin F. (PDF, 0.04 MB). Cell. 27 January 1995, 80 (2): 269–278. PMID 7834746. doi:10.1016/0092-8674(95)90409-3.
- Mashaghi et al. Hydration strongly affects the molecular and electronic structure of membrane phospholipids. 136, 114709 (2012). [2012-05-17]. (原始内容存档于15 May 2016). 已忽略未知参数
|df=(帮助) - Lewis BA, Engelman DM. . J. Mol. Biol. May 1983, 166 (2): 211–7. PMID 6854644. doi:10.1016/S0022-2836(83)80007-2.
- Zaccai G, Blasie JK, Schoenborn BP. . Proc. Natl. Acad. Sci. U.S.A. January 1975, 72 (1): 376–380. Bibcode:1975PNAS...72..376Z. PMC 432308. PMID 16592215. doi:10.1073/pnas.72.1.376.
- Nagle JF, Tristram-Nagle S. . Biochim. Biophys. Acta. November 2000, 1469 (3): 159–95 [2018-09-01]. PMC 2747654. PMID 11063882. doi:10.1016/S0304-4157(00)00016-2. (原始内容存档于2018-06-19).
- Parker J, Madigan MT, Brock TD, Martinko JM. 10th. Englewood Cliffs, N.J: Prentice Hall. 2003. ISBN 0-13-049147-0.
- Marsh D. . Proc. Natl. Acad. Sci. U.S.A. July 2001, 98 (14): 7777–82. Bibcode:2001PNAS...98.7777M. PMC 35418. PMID 11438731. doi:10.1073/pnas.131023798.
- Marsh D. . Eur. Biophys. J. December 2002, 31 (7): 559–62. PMID 12602343. doi:10.1007/s00249-002-0245-z.
- Rawicz W, Olbrich KC, McIntosh T, Needham D, Evans E. . Biophys. J. July 2000, 79 (1): 328–39. Bibcode:2000BpJ....79..328R. PMC 1300937. PMID 10866959. doi:10.1016/S0006-3495(00)76295-3.
- Trauble H, Haynes DH. . Chem. Phys. Lipids. 1971, 7 (4): 324–35. doi:10.1016/0009-3084(71)90010-7.
- Bretscher MS. . Nature New Biology. 1 March 1972, 236 (61): 11–12. PMID 4502419. doi:10.1038/newbio236011a0.
- Verkleij AJ, Zwaal RF, Roelofsen B, Comfurius P, Kastelijn D, van Deenen LL. . Biochim. Biophys. Acta. October 1973, 323 (2): 178–93 [2018-09-01]. PMID 4356540. doi:10.1016/0005-2736(73)90143-0. (原始内容存档于2018-09-01).
- Bell RM, Ballas LM, Coleman RA. . J. Lipid Res. 1 March 1981, 22 (3): 391–403 [2018-09-01]. PMID 7017050. (原始内容存档于2019-10-17).
- Bretscher MS. . Science. August 1973, 181 (4100): 622–629. Bibcode:1973Sci...181..622B. PMID 4724478. doi:10.1126/science.181.4100.622.
- Rothman JE, Kennedy EP. . Proc. Natl. Acad. Sci. U.S.A. May 1977, 74 (5): 1821–5. Bibcode:1977PNAS...74.1821R. PMC 431015. PMID 405668. doi:10.1073/pnas.74.5.1821.
- Kornberg RD, McConnell HM. . Biochemistry. March 1971, 10 (7): 1111–20. PMID 4324203. doi:10.1021/bi00783a003.
- Litman BJ. . Biochemistry. July 1974, 13 (14): 2844–8. PMID 4407872. doi:10.1021/bi00711a010.
- Crane JM, Kiessling V, Tamm LK. . Langmuir. February 2005, 21 (4): 1377–88. PMID 15697284. doi:10.1021/la047654w.
- Kalb E, Frey S, Tamm LK. . Biochim. Biophys. Acta. January 1992, 1103 (2): 307–16 [2018-09-01]. PMID 1311950. doi:10.1016/0005-2736(92)90101-Q. (原始内容存档于2018-09-01).
- Lin WC, Blanchette CD, Ratto TV, Longo ML. . Biophys. J. January 2006, 90 (1): 228–37. Bibcode:2006BpJ....90..228L. PMC 1367021. PMID 16214871. doi:10.1529/biophysj.105.067066.
- Berg, Howard C. Extended Paperback. Princeton, N.J: Princeton University Press. 1993. ISBN 0-691-00064-6.
- Dietrich C, Volovyk ZN, Levi M, Thompson NL, Jacobson K. . Proc. Natl. Acad. Sci. U.S.A. September 2001, 98 (19): 10642–7. Bibcode:2001PNAS...9810642D. PMC 58519. PMID 11535814. doi:10.1073/pnas.191168698.
- Alberts, Bruce. . . Garland Science. 2017. ISBN 9781317563747 (英语).
- Fadok VA, Bratton DL, Frasch SC, Warner ML, Henson PM. . Cell Death Differ. July 1998, 5 (7): 551–62. PMID 10200509. doi:10.1038/sj.cdd.4400404.
- Anderson HC, Garimella R, Tague SE. . Front. Biosci. January 2005, 10 (1–3): 822–37 [2018-09-01]. PMID 15569622. doi:10.2741/1576. (原始内容存档于2020-05-27).
- Eanes ED, Hailer AW. . Calcif. Tissue Int. January 1987, 40 (1): 43–8. PMID 3103899. doi:10.1007/BF02555727.
- Kim J, Mosior M, Chung LA, Wu H, McLaughlin S. . Biophys. J. July 1991, 60 (1): 135–48. Bibcode:1991BpJ....60..135K. PMC 1260045. PMID 1883932. doi:10.1016/S0006-3495(91)82037-9.
- Koch AL. . J. Mol. Evol. 1984, 21 (3): 270–7. Bibcode:1985JMolE..21..270K. PMID 6242168. doi:10.1007/BF02102359.
- . [2018-09-01]. (原始内容存档于2014-02-22).
- Alberts, Bruce. 4th. New York: Garland Science. 2002. ISBN 0-8153-4072-9.
- Martelli PL, Fariselli P, Casadio R. . Bioinformatics. 2003, 19 (Suppl 1): i205–11 [2018-09-01]. PMID 12855459. doi:10.1093/bioinformatics/btg1027. (原始内容存档于2013-04-15).
- Filmore D. . Modern Drug Discovery. 2004, 11: 24–9.
- Montal M, Mueller P. . Proc. Natl. Acad. Sci. December 1972, 69 (12): 3561–6. Bibcode:1972PNAS...69.3561M. PMC 389821. PMID 4509315. doi:10.1073/pnas.69.12.3561.
- Melikov KC, Frolov VA, Shcherbakov A, Samsonov AV, Chizmadzhev YA, Chernomordik LV. . Biophys. J. April 2001, 80 (4): 1829–36. Bibcode:2001BpJ....80.1829M. PMC 1301372. PMID 11259296. doi:10.1016/S0006-3495(01)76153-X.
- Neher E, Sakmann B. . Nature. April 1976, 260 (5554): 799–802. Bibcode:1976Natur.260..799N. PMID 1083489. doi:10.1038/260799a0.
- Y. Roiter, M. Ornatska, A. R. Rammohan, J. Balakrishnan, D. R. Heine, and S. Minko, Interaction of Nanoparticles with Lipid Membrane, Nano Letters, vol. 8, iss. 3, pp. 941–944 (2008).
- Heuser JE, Reese TS, Dennis MJ, Jan Y, Jan L, Evans L. . J. Cell Biol. May 1979, 81 (2): 275–300 [2018-09-01]. PMC 2110310. PMID 38256. doi:10.1083/jcb.81.2.275. (原始内容存档于2019-10-17).
- Dubinnyi MA, Lesovoy DM, Dubovskii PV, Chupin VV, Arseniev AS. . Solid State Nucl Magn Reson. June 2006, 29 (4): 305–311. PMID 16298110. doi:10.1016/j.ssnmr.2005.10.009.
- Tokumasu F, Jin AJ, Dvorak JA. . J. Electron Micros. 2002, 51 (1): 1–9. PMID 12003236. doi:10.1093/jmicro/51.1.1.
- . Langmuir. 2003, 19 (5): 1632–40. doi:10.1021/la026427w.
- . Biophys. J. July 2006, 91 (1): 217–26. Bibcode:2006BpJ....91..217S. PMC 1479081. PMID 16617084. doi:10.1529/biophysj.106.081398.
- Alireza Mashaghi et al., Hydration strongly affects the molecular and electronic structure of membrane phospholipids. J. Chem. Phys. 136, 114709 (2012) . [2012-05-17]. (原始内容存档于15 May 2016). 已忽略未知参数
|df=(帮助) - Chakrabarti AC. . Amino Acids. 1994, 6 (3): 213–29. PMID 11543596. doi:10.1007/BF00813743.
- Hauser H, Phillips MC, Stubbs M. . Nature. October 1972, 239 (5371): 342–4. Bibcode:1972Natur.239..342H. PMID 12635233. doi:10.1038/239342a0.
- Papahadjopoulos D, Watkins JC. . Biochim. Biophys. Acta. September 1967, 135 (4): 639–52 [2018-09-01]. PMID 6048247. doi:10.1016/0005-2736(67)90095-8. (原始内容存档于2018-09-01).
- Paula S, Volkov AG, Van Hoek AN, Haines TH, Deamer DW. . Biophys. J. January 1996, 70 (1): 339–48. Bibcode:1996BpJ....70..339P. PMC 1224932. PMID 8770210. doi:10.1016/S0006-3495(96)79575-9.
- Xiang TX, Anderson BD. . J. Membr. Biol. June 1994, 140 (2): 111–22. PMID 7932645. doi:10.1007/bf00232899.
- Gouaux E, Mackinnon R. . Science. December 2005, 310 (5753): 1461–5. Bibcode:2005Sci...310.1461G. PMID 16322449. doi:10.1126/science.1113666.
- Gundelfinger ED, Kessels MM, Qualmann B. . Nat. Rev. Mol. Cell Biol. February 2003, 4 (2): 127–39. PMID 12563290. doi:10.1038/nrm1016.
- Steinman RM, Brodie SE, Cohn ZA. . J. Cell Biol. March 1976, 68 (3): 665–87 [2018-09-01]. PMC 2109655. PMID 1030706. doi:10.1083/jcb.68.3.665. (原始内容存档于2019-10-17).
- YashRoy R.C. (1999) 'Exocytosis in prokaryotes' and its role in salmonella invasion. ICAR NEWS - A Science and Technology Newsletter, (Oct-Dec) vol. 5(4), page 18.https://www.researchgate.net/publication/230822402_'Exocytosis_in_prokaryotes'_and_its_role_in_Salmonella_invasion?ev=prf_pub
- YashRoy R C (1993) Electron microscope studies of surface pili and vesicles of Salmonella 3,10:r:- organisms. Ind Jl of Anim Sci 63, 99-102.https://www.researchgate.net/publication/230817087_Electron_microscope_studies_of_surface_pilli_and_vesicles_of_Salmonella_310r-_organisms?ev=prf_pub
- YashRoy R.C. (1998) Discovery of vesicular exocytosis in prokaryotes and its role in Salmonella invasion. Current Science, vol. 75(10), pp. 1062-1066.https://www.researchgate.net/publication/230793568_Discovery_of_vesicular_exocytosis_in_prokaryotes_and_its_role_in_Salmonella_invasion?ev=prf_pub
- YashRoy RC. . Indian Journal of Poultry Science. 1998, 33 (2): 119–123 [2018-09-01]. (原始内容存档于2018-09-01).
- Neumann E, Schaefer-Ridder M, Wang Y, Hofschneider PH. . EMBO J. 1982, 1 (7): 841–5. PMC 553119. PMID 6329708.
- Demanèche S, Bertolla F, Buret F, 等. . Appl. Environ. Microbiol. August 2001, 67 (8): 3440–4. PMC 93040. PMID 11472916. doi:10.1128/AEM.67.8.3440-3444.2001.
- Garcia ML. . Nature. July 2004, 430 (6996): 153–5. Bibcode:2004Natur.430..153G. PMID 15241399. doi:10.1038/430153a.
- McIntosh TJ, Simon SA. . Annu. Rev. Biophys. Biomol. Struct. 2006, 35 (1): 177–98. PMID 16689633. doi:10.1146/annurev.biophys.35.040405.102022.
- Suchyna TM, Tape SE, Koeppe RE, Andersen OS, Sachs F, Gottlieb PA. . Nature. July 2004, 430 (6996): 235–40. Bibcode:2004Natur.430..235S. PMID 15241420. doi:10.1038/nature02743.
- Hallett FR, Marsh J, Nickel BG, Wood JM. . Biophys. J. February 1993, 64 (2): 435–42. Bibcode:1993BpJ....64..435H. PMC 1262346. PMID 8457669. doi:10.1016/S0006-3495(93)81384-5.
- Boal, David H. . Cambridge, UK: Cambridge University Press. 2001. ISBN 0-521-79681-4.
- Rutkowski CA, Williams LM, Haines TH, Cummins HZ. . Biochemistry. June 1991, 30 (23): 5688–96. PMID 2043611. doi:10.1021/bi00237a008.
- Evans E, Heinrich V, Ludwig F, Rawicz W. . Biophys. J. October 2003, 85 (4): 2342–50. Bibcode:2003BpJ....85.2342E. PMC 1303459. PMID 14507698. doi:10.1016/S0006-3495(03)74658-X.
- YashRoy R.C. (1994) Destabilisation of lamellar dispersion of thylakoid membrane lipids by sucrose. Biochimica et Biophysica Acta, vol. 1212, pp. 129-133.https://www.researchgate.net/publication/15042978_Destabilisation_of_lamellar_dispersion_of_thylakoid_membrane_lipids_by_sucrose?ev=prf_pub
- Weaver JC, Chizmadzhev YA. . Biochemistry and Bioenergetics. 1996, 41 (2): 135–60. doi:10.1016/S0302-4598(96)05062-3.
- Yeagle, Philip. 2nd. Boston: Academic Press. 1993. ISBN 0-12-769041-7.
- Papahadjopoulos D, Nir S, Düzgünes N. . J. Bioenerg. Biomembr. April 1990, 22 (2): 157–79. PMID 2139437. doi:10.1007/BF00762944.
- Leventis R, Gagné J, Fuller N, Rand RP, Silvius JR. . Biochemistry. November 1986, 25 (22): 6978–87. PMID 3801406. doi:10.1021/bi00370a600.
- Markin VS, Kozlov MM, Borovjagin VL. . Gen. Physiol. Biophys. October 1984, 3 (5): 361–77. PMID 6510702.
- Chernomordik LV, Kozlov MM. . Annu. Rev. Biochem. 2003, 72 (1): 175–207. PMID 14527322. doi:10.1146/annurev.biochem.72.121801.161504.
- Georgiev, Danko D .; James F . Glazebrook. . Lyshevski, Sergey Edward (编). . Nano and Microengineering Series. CRC Press. 2007: 17–1–17–41 [2018-09-01]. ISBN 978-0-8493-8528-5. (原始内容存档于2016-01-16).
- Chen YA, Scheller RH. . Nat. Rev. Mol. Cell Biol. February 2001, 2 (2): 98–106. PMID 11252968. doi:10.1038/35052017.
- Köhler G, Milstein C. . Nature. August 1975, 256 (5517): 495–7. Bibcode:1975Natur.256..495K. PMID 1172191. doi:10.1038/256495a0.
- Jordan, Carol A.; Neumann, Eberhard; Sowershi mason, Arthur E. . New York: Plenum Press. 1989. ISBN 0-306-43043-6.
- Immordino ML, Dosio F, Cattel L. . Int J Nanomed. 2006, 1 (3): 297–315. PMC 2426795. PMID 17717971. doi:10.2217/17435889.1.3.297.
- Chonn A, Semple SC, Cullis PR. . J. Biol. Chem. 15 September 1992, 267 (26): 18759–65 [2018-09-01]. PMID 1527006. (原始内容存档于2019-10-17).
- Boris EH, Winterhalter M, Frederik PM, Vallner JJ, Lasic DD. . Advanced Drug Delivery Reviews. 1997, 24 (2–3): 165–77. doi:10.1016/S0169-409X(96)00456-5.
- Maeda H, Sawa T, Konno T. . J Control Release. July 2001, 74 (1–3): 47–61 [2018-09-01]. PMID 11489482. doi:10.1016/S0168-3659(01)00309-1. (原始内容存档于2018-09-01).
- Lopes DE, Menezes DE, Kirchmeier MJ, Gagne JF. . Journal of Liposome Research. 1999, 9 (2): 199–228. doi:10.3109/08982109909024786.
- Matsumura Y, Gotoh M, Muro K, 等. . Ann. Oncol. March 2004, 15 (3): 517–25 [2018-09-01]. PMID 14998859. doi:10.1093/annonc/mdh092. (原始内容存档于2013-04-15).
- . Biacore Inc. Retrieved Feb 12, 2009.
- Nanion Technologies. Automated Patch Clamp 页面存档备份,存于. Retrieved Feb 28, 2010. (PDF)
- Bermejo, M. et al. (2004). PAMPA – a drug absorption in vitro model 7. Comparing rat in situ, Caco-2, and PAMPA permeability of fluoroquinolones. Pharm. Sci., 21: 429-441.
- Avdeef, A. et al. (2005). Caco-2 permeability of weakly basic drugs predicted with the Double-Sink PAMPA pKaflux method. Pharm. Sci., 24: 333-349.
- Avdeef, A. et al. (2004). PAMPA – a drug absorption in vitro model 11. Matching the in vivo unstirred water layer thickness by individual-well stirring in microtitre plates. Pharm. Sci., 22: 365-374.
- Dagenais, C. et al. (2009). P-glycoprotein deficient mouse in situ blood–brain barrier permeability and its prediction using an in combo PAMPA model. Eur. J. Phar. Sci., 38(2): 121-137.
- Sinkó, B. et al. (2009). A PAMPA Study of the Permeability-Enhancing Effect of New Ceramide Analogues. Chemistry & Biodiversity, 6: 1867-1874.
- Loeb J. . Science. December 1904, 20 (519): 777–786. Bibcode:1904Sci....20..777L. PMID 17730464. doi:10.1126/science.20.519.777.
- Fricke H. . Journal of General Physiology. 1925, 9 (2): 137–52. PMC 2140799. PMID 19872238. doi:10.1085/jgp.9.2.137.
- Dooren LJ, Wiedemann LR. . Journal of European Journal of Pediatrics. 1986, 145 (5): 329. doi:10.1007/BF00439232.
- Gorter E, Grendel F. . Journal of Experimental Medicine. 1925, 41 (4): 439–43. PMC 2130960. PMID 19868999. doi:10.1084/jem.41.4.439.
- Sjöstrand FS, Andersson-Cedergren E, Dewey MM. . J. Ultrastruct. Res. April 1958, 1 (3): 271–87. PMID 13550367. doi:10.1016/S0022-5320(58)80008-8.
- Robertson JD. . Prog. Biophys. Mol. Biol. 1960, 10: 343–418. PMID 13742209.
- Robertson JD. . Biochem. Soc. Symp. 1959, 16: 3–43. PMID 13651159.
- Mueller P, Rudin DO, Tien HT, Wescott WC. . Nature. June 1962, 194 (4832): 979–80. Bibcode:1962Natur.194..979M. PMID 14476933. doi:10.1038/194979a0.
- Bangham, A. D.; Horne, R. W. . Journal of Molecular Biology. 1964, 8 (5): 660–668. PMID 14187392. doi:10.1016/S0022-2836(64)80115-7.
外部链接
| 维基共享资源中相关的多媒体资源:磷脂双分子层 |
- Avanti Lipids 页面存档备份,存于 最大的脂质供应商之一,可以获取关于脂质性质以及磷脂双分子层制备技术的技术信息。
- LIPIDAT 关于脂质物理性质的数据库
- Structure of Fluid Lipid Bilayers 与磷脂双分子层的横截面结构相关的模拟程序和出版物的链接。
- Lipid Bilayers and the Gramicidin Channel(需要Java插件)用图像和视频显示双分子层的分子动力学模拟结果。
- Structure of Fluid Lipid Bilayers (来自加州大学欧文分校的斯蒂芬怀特实验室)
- Animations of lipid bilayer dynamics (需要Flash插件)