囊泡
分類
液泡
液泡(vacuoles)是主要含有水的一種細胞器,由多囊體的融合衍生而成[1]。植物細胞在細胞的中心部分有一個較大的液泡,用於控制滲透和營養物質的儲存。在某些生物中,特別是在纖毛蟲中發現了具有收縮性的液泡。 這些液泡從細胞質中吸收水分,並將其從細胞中排出,以避免由於滲透壓而破裂。
溶酶體
溶酶體(Lysosomes)外包單層膜,膜上有轉運蛋白,而內部則富含酸性水解酶,負責吞噬及自噬等降解途徑將進入細胞的外源性大分子物質和出現異常的大分子物質降解,從而為細胞提供氨基酸及脂質等營養物質[2],並且參與質膜修復及細胞信號傳導等細胞過程。
脂質體
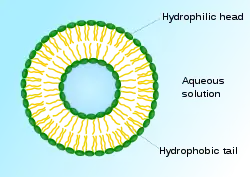
脂質體(liposomes)是磷脂分散在水中形成的一個包封着部分水相(aqueous phase)的類球狀封閉囊泡。脂質體的形態與細胞膜相似,並且能夠融合各種物質。脂質體被認為是體外和體內生物活性物質的最佳遞送系統,以及最成功的藥物載體系統。
運輸囊泡
運輸囊泡(Transport vesicles)在真核生物中,通過在不同細胞器及細胞表面進行轉運發揮它的作用。目前已知的運輸囊泡有網格蛋白囊泡、外被體蛋白Ⅰ(coat protein、COPI囊泡)和COPⅡ囊泡。這些運輸囊泡在細胞膜的生物合成、細胞器功能和形態的動態平衡,以及蛋白質分泌等方面都發揮重要作用[3]。目前已知在真核生物中,約有三分之一蛋白質的早期分泌途徑依賴着COPⅡ囊泡的運輸。早期分泌途徑中,COPⅡ囊泡介導新合成的分泌性蛋白質和膜脂質等貨物從內質網轉運至順面高爾基復合體(Golgi)。COPⅠ囊泡則介導貨物分子從順面Golgi逆向轉運至內質網,以及貨物分子在Golgi膜囊間的轉運[4][5]。晚期分泌途徑中,含銜接蛋白-1(adaptor protein 1、AP-1)、AP-3及AP-4蛋白復合物的網格蛋白囊泡可參與貨物分子在反面Golgi與內體、溶酶體及質膜間的轉運[6][7]。含AP-2蛋白的網格蛋白囊泡參與貨物的胞吞途徑,通過質膜內陷形成囊泡,將細胞外或質膜表面的貨物包裹到囊泡內,並且運入細胞[8]。
- COPⅠ囊泡:最初研究者利用三磷酸鳥苷(GTP)衍生物GTPγS(一種富含高爾基體膜的細胞質與抗水解的GTP衍生物)共培養時,發現高爾基體池之間存在一種囊泡轉運結構[9](後來在真核細胞中也證實此結構的存在[10])。除了脂質成分外,參與此囊泡形成的成份還有7種外被體蛋白(即外被體α、β、β′、γ、δ、ε、ζ)。這些外被體蛋白相互作用形成的復合物就是COPⅠ囊泡[11][12]。亞單位α、β′、ε在結構上與網格蛋白及COPⅡ囊泡的外層組分具有較高的一致性,形成復合物的內層組分稱為B亞復合物(主要負責與靶蛋白結合),而亞單位β、γ、δ、ζ 與網格蛋白及COPⅡ囊泡的內層組分相似,形成復合物的內層組分稱為F亞復合物,該亞復合物主要負責與靶蛋白結合,並且直接與COPⅠ囊泡形成的招募者ADP核糖基化因子(ADP ribosylation factors)結合,從而參與啟動囊泡的逆向轉運[11][12][13]。同時又發現COPγ、COPζ各有2種亞型,即γ1、γ2、ζ1、ζ2[14],這些亞型間的交叉組合可形成4種COPⅠ囊泡。有研究發現,3T3細胞中約五成的COPⅠ囊泡包含γ1ζ1,約三成包含γ2ζ1,約兩成包含γ1ζ2,僅有不足半成的COPⅠ囊泡包含γ2ζ2[15]。另外一份研究則發現細胞中,超過七成的γ1型COPⅠ復合物定位於順式高爾基體,超過六成的γ2型COPⅠ復合物定位於反式高爾基體,約八成的ζ1型COPⅠ復合物定位於順式高爾基體,而ζ2型COPⅠ復合物因缺乏特異性抗體而尚未明確定位[16]。由此可見,COPⅠ囊泡的類型,可能與囊泡的起源部位,以及定向轉運至的靶細胞器膜有一定的關係[17]。
- COPⅡ囊泡:主要是由五種可溶性蛋白,即小GTP酶蛋白Sar1、Sec23及Sec24(這兩種蛋白會緊密結合形成蝴蝶結狀異二聚體)、Sec13及Sec31組成的復合物[18],並且以分層方式按順序組裝至內質網膜上,並且介導COPⅡ囊泡的形成。根據COPⅡ囊泡裝配的貨物分子大小,Sec31 C端的氨基酸序列可以成不同幾何形狀的COPⅡ籠型,從而使COPⅡ囊泡容納前膠原、乳糜微粒及載脂蛋白等超過COPⅡ囊泡本身大小的大型貨物分子[19],這可能與E3泛素連接酶通過其配體銜接蛋白KLHL12,使Sec31泛素化有關[20][21],從而令Sec31招募到有利於形成管狀COPⅡ衣被結構的其他因子,同時調節Sec23的活性而激活Sar1-GTP的GTP酶水解活性。除了上述五種可溶性蛋白外,進一步研究發現Sec12和Sec16對COPⅡ囊泡的形成也非常重要[22]。
分泌泡
分泌泡(Secretory vesicles)包含將要從細胞中排出的物質。細胞排泄物質的原因有很多,其中一個原因是要處理廢物,而另一個原因與細胞的功能有關。在較大的生物體內,某些細胞專門產生某些化學物質,而這些化學物質儲存在分泌泡中,並且在需要時釋放出來。
細胞外囊泡
細胞外囊泡(Extracellular vesicles、EVs)是一類由活細胞旁分泌釋放到周圍環境中的雙層脂質膜結構的微小囊泡,主要分為外排體(exosome)、微囊泡(microvesicle)即微粒(microparticle)、凋亡小體(apoptosis body)及癌小體(oncosome)四類,然而尚可以細分為核外粒體(ectosome)、神經突觸小體(Synaptic vesicle)及基質小泡(matrix vesicle)等,可以由複雜的真核生物,包括革蘭氏陰性菌和革蘭氏陽性菌、分枝桿菌及真菌等產生[24][25],幾乎所有細胞都能夠釋放EVs。
- 外排體:外定義的變異範圍從30~100 nm,40~100 nm,50~150 nm到40~200 nm[26][27][28][29],然而亦有指其直徑通常在30~100 nm,具有雙層分子膜結構,形態呈球形小體、杯狀或扁形,而在體液中主要以球形小體的形式存在,並且可以通過超速離心的方法獲得。外排體存在於血清、血漿、尿液、母乳及惡性體液(例如惡性胸水及惡性腹水等),幾乎所有類型的細胞都能釋放外排體。外排體中包含各種不同的成分,例如蛋白質、酶類、去氧核糖核酸、信使核糖核酸、非編碼核糖核酸及脂質等,並且含有細胞因子及生長因子受體等。外排體被認為是細胞間通訊的第3條途徑,積極地充當不同組織和細胞之間的生物活性分子。此外,外排體廣泛地參與免疫反應,因為它攜帶來源細胞的細胞膜表面相關抗原、生物活性小分子物質、免疫刺激因子及免疫抑制分子等。除此之外,外排體可以調節腫瘤微環境,因為腫瘤細胞釋放的外泌體有利於非惡性組織的惡化,從而促進腫瘤轉移。
- 微囊泡、微粒:是機體各種細胞在正常或病理狀態下從細胞質膜上脫落而釋放的膜性小囊泡,直徑通常在30至1 000 nm。血小板在正常生理狀態下是微囊泡的來源[30],當内皮細胞及血液細胞[31]等細胞發生激活或凋亡時,在細胞因子及剪切力等觸發因素下也可以產生微囊泡。首先,微囊泡的表面配體與靶細胞的受體結合,激活或者抑制靶細胞內的轉導通路,例如促進組織因子介導的凝血反應。其次,微囊泡形成時會包裹母細胞的成分,並且傳遞到靶細胞中,使其具有新的生物學功能。第三,微囊泡會將母細胞的受體轉移到靶細胞而呈現相關受體表型。第四,微囊泡能轉移完整的細胞器或病毒等致病因子,並且傳遞給其他細胞[32][33][34]。
- 凋亡小體:由少量皺縮的細胞質和固縮的染色質碎塊組成。
- 癌小體:
- 核外粒體:一種在質膜處聚集並從質膜釋放的細胞外囊泡,其標記物有TyA和C1a(而非外排體的標記物CD63和CD61)。儘管英文名稱與外排體相似,但是並非同一種細胞外囊泡。因為外排體從多囊體釋放,而核外粒體則被快速組裝在質膜中,在特定的細胞刺激下會大大增加,最終從細胞的表面釋放[35]。此外,外排體在其初始狀態下的表現為向着多囊體內含物方向的向內小芽,而核外粒體在初始狀態下的表現則為離散的質膜結構域,並且以與其胞質表面相關的緻密物質層作為標誌物,核外粒體的結構域在幾秒或最多幾分鐘內就會向外發芽並被夾成圓形的囊泡[35]。釋放出來的核外粒體和外排體均包含着由蛋白質、RNA和DNA序列組成的基質,然而在核外粒體中的含量更高[35]。目前已知核外粒體擁有着多種英文異稱,包括「nanoparticles」、「microparticles」、「microvesicles」、「shedding vesicles」、「shedding bodies」、「exovesicles」、「secretory vesicles」,以及「oncosomes」[35]。
- 基質小泡:基質小泡位於細胞外的空間或細胞外基質內。 1967年,Clarke Anderson及Ermanno Bonucci分別使用電子顯微鏡發現基質小泡的存在[36][37]。這些源自細胞的基質小泡專門用於啟動各種組織(包括骨骼、軟骨和牙本質)中基質的生物礦化作用。在正常鈣化過程中,鈣和磷酸根離子大量流入細胞,伴隨著細胞凋亡(從基因上確定為自毀)和基質小泡的形成。鈣負荷會導致磷脂酰絲氨酸:鈣:磷酸鹽複合物在質膜中形成,部分由annexin所介導。基質囊泡從質膜發芽,準確來說是在與細胞外基質相互作用的位點。因此,基質小泡將鈣、磷酸鹽、脂質和annexin傳遞到細胞外基質,其作用幫助形成成核礦物質。 除非高爾基體不存在,否則這些過程將被精確地協調,在適當的時間和地點實現組織基質的礦化。
循環細胞膜囊泡
循環細胞膜囊泡(Tissue factor-carrying microvesicles、TF-MV):是一種細胞在激活、受損或凋亡時從細胞膜上釋放的脂質囊泡(直徑約0.1~1 μm),具有促凝活性的TF-MV最主要來源於動脈粥樣硬化斑塊[38][39]。TF-MV攜有母體細胞內容物或特異性表面蛋白,並且因可以結合受體細胞而會影響內皮功能障礙及凝血等疾病的生物學過程。目前已知其在靜脈血栓形成及相關疾病的發生及發展中佔據重要的作用,可以獨立地觸發凝血級聯反應[40],甚至可以用來預測血栓性疾病的發生和發展,以及嚴重程度分級[41][42][43][44]。有研究指出參與急性缺血性卒中,血管炎症過程的炎症介質正是循環白細胞膜囊泡,可以促進顱內血管動脈粥樣硬化的進程[45],然而組織因子途徑抑制物(TFPI)的表達會隨着TF-MV的表達增加而明顯增加[43],可以稱是生物體內凝血與抗凝的激活矛盾[46]。
電分析化學
電分析化學法具有時間分辨率和靈敏度均較高的特點,而研究人員先前對胞吐過程進行研究時所採用的光學方法(例如引入光學標記分子及光譜成像等),雖然在研究胞吐過程中發揮着重要作用[49][50][51],但是這些方法均存在著時間分辨率低及定量困難等缺點。因此,能夠克服這些缺點的電分析化學法在單神經囊泡的分析方面,擁有着頗大的優勢[52]。
1991年, 有科研人員首次採用一種名為「單細胞電流法」的技術,實現胞吐過程中單囊泡釋放神經遞質的定量、動態、快速分析[53][54]。許多研究人員隨後使用這個方法研究藥物及環境等因素對囊泡釋放神經遞質的影響[55][56][57]。
單囊泡原位電化學計數法
目前已知瑞典哥德堡大學的科研人員分成不同研究小組,並且在此方面做出一系列的工作,發展三種電化學計數法,即毛細管電泳-電化學計數法、單囊泡電化學計數法(VIEC),以及單囊泡原位電化學計數法(IVIEC)[52]。
- 毛細管電泳-電化學計數法:這是第一套單囊泡內包被神經遞質的定量分析裝置,巧妙地結合了毛細管電泳、微流控芯片和電化學檢測技術。由於毛細管電泳的毛細管出口被固定在聚二甲基矽氧烷制備的微流控芯片上,而且在出口處引入囊泡膜裂解液(即高濃度十二烷基磺酸鈉),以及放置柱狀碳纖維微電極。因此,在毛細管內的單個囊泡(已被電場分離出),會被裂解液破開囊泡膜,使電極可以完全檢測神經遞質,實現單一囊泡儲存神經遞質的定量測定[58]。成功地令PC12细胞(一種大鼠腎上腺嗜鉻細胞瘤細胞)及鼠腦組織分離出的神經囊泡內包被神經遞質,可以被定量分析[59][60],然而這種定量分析裝置存在複雜且難於操控的缺點[52]。
- 單囊泡電化學計數法:2015年,有科技人員發展了VIEC,而VIEC不需要預先進行電泳,就可以裂解電極表面的單個囊泡,從而定量分析單個囊泡內包被神經遞質。在裝置的盤狀碳電極上,從腎上腺髓質中分離出的腎上腺嗜鉻囊泡會發生反應,兒茶酚胺類神經遞質等囊泡內包被神經遞質,被電極電化學氧化,從而實現檢測[61]。其他與之相似的單囊泡電化學計數法在此後陸續被其他研究人員所開發[62][63][64],並且具有一定的研究價值,例如發現囊泡會在電極的表面形成一個很快就消失的納米小孔[65],而該小孔的位置對電極上檢測到釋放神經遞質的比例有影響[66],又例如發現囊泡膜破裂的驅動力主要是電穿孔[67],而電穿孔的發生會被膜內多肽或膜蛋白的存在所阻止[67]。除此之外,有研究人員發現溫度提高後容易誘發電穿孔的形成,因為囊泡膜內的膜蛋白在磷脂雙分子層中的運動速率會增大,並且提高膜磷脂與電極緊密結合的可能性[65];另外又有研究人員發現尺寸愈大的囊泡因與電極接觸的面積越大,囊泡膜磷脂與電極形成緊密結合的點位越多,而更容易發生電穿孔[65][68]。
參考文獻
- Cui, Y; Cao, W; He, Y; Zhao, Q; Wakazaki, M; Zhuang, X; Gao, J; Zeng, Y; Gao, C; Ding, Y; Wong, HY; Wong, WS; Lam, HK; Wang, P; Ueda, T; Rojas-Pierce, M; Toyooka, K; Kang, BH; Jiang, L. . Nature plants. 2019-01, 5 (1): 95–105 [2020-02-10]. PMID 30559414. doi:10.1038/s41477-018-0328-1. (原始内容存档于2020-03-03).
- Saftig, P; Klumperman, J. . Nature reviews. Molecular cell biology. 2009-09, 10 (9): 623–35 [2020-02-11]. PMID 19672277. doi:10.1038/nrm2745. (原始内容存档于2020-03-03).
- Béthune, J; Wieland, FT. . Annual review of biophysics. 2018-05-20, 47: 63–83 [2020-02-12]. PMID 29345989. doi:10.1146/annurev-biophys-070317-033259.
- Bacia, K. . Angewandte Chemie (International ed. in English). 2013-11-25, 52 (48): 12486–8 [2020-02-12]. PMID 24249548. doi:10.1002/anie.201308937. (原始内容存档于2020-03-03).
- Faini, M; Beck, R; Wieland, FT; Briggs, JA. . Trends in cell biology. 2013-06, 23 (6): 279–88 [2020-02-12]. PMID 23414967. doi:10.1016/j.tcb.2013.01.005.
- Robinson, MS. . Traffic (Copenhagen, Denmark). 2015-12, 16 (12): 1210–38 [2020-02-12]. PMID 26403691. doi:10.1111/tra.12335. (原始内容存档于2020-03-03).
- Guo, Y; Sirkis, DW; Schekman, R. . Annual review of cell and developmental biology. 2014, 30: 169–206 [2020-02-12]. PMID 25150009. doi:10.1146/annurev-cellbio-100913-013012.
- Kirchhausen, T; Owen, D; Harrison, SC. . Cold Spring Harbor perspectives in biology. 2014-05-01, 6 (5): a016725 [2020-02-12]. PMID 24789820. doi:10.1101/cshperspect.a016725. (原始内容存档于2020-03-03).
- Malhotra, V; Serafini, T; Orci, L; Shepherd, JC; Rothman, JE. . Cell. 1989-07-28, 58 (2): 329–36 [2020-02-12]. PMID 2752426. doi:10.1016/0092-8674(89)90847-7.
- Waters, MG; Serafini, T; Rothman, JE. . Nature. 1991-01-17, 349 (6306): 248–51 [2020-02-12]. PMID 1898986. doi:10.1038/349248a0 (英语).
- Hara-Kuge, S; Kuge, O; Orci, L; Amherdt, M; Ravazzola, M; Wieland, FT; Rothman, JE. . The Journal of cell biology. 1994-03, 124 (6): 883–92 [2020-02-12]. PMID 8132710. doi:10.1083/jcb.124.6.883. (原始内容存档于2020-03-03).
- Jackson, LP. . Current opinion in cell biology. 2014-08, 29: 67–73 [2020-02-12]. PMID 24840894. doi:10.1016/j.ceb.2014.04.009. (原始内容存档于2020-03-03).
- Lee, C; Goldberg, J. . Cell. 2010-07-09, 142 (1): 123–32 [2020-02-12]. PMID 20579721. doi:10.1016/j.cell.2010.05.030.
- Blagitko, N; Schulz, U; Schinzel, AA; Ropers, HH; Kalscheuer, VM. . Human molecular genetics. 1999-12, 8 (13): 2387–96 [2020-02-12]. PMID 10556286. doi:10.1093/hmg/8.13.2387.
- Beck, R; Rawet, M; Wieland, FT; Cassel, D. . FEBS letters. 2009-09-03, 583 (17): 2701–9 [2020-02-12]. PMID 19631211. doi:10.1016/j.febslet.2009.07.032.
- Moelleken, J; Malsam, J; Betts, MJ; Movafeghi, A; Reckmann, I; Meissner, I; Hellwig, A; Russell, RB; Söllner, T; Brügger, B; Wieland, FT. . Proceedings of the National Academy of Sciences of the United States of America. 2007-03-13, 104 (11): 4425–30 [2020-02-12]. PMID 17360540. doi:10.1073/pnas.0611360104.
- ZHANGGuang-ya; XIONGJie; CHENFeng-ling. . Yixue Zongshu. 2016, (1): 5–9. doi:10.3969/j.issn.1006-2084.2016.01.002.
- Matsuoka, K; Orci, L; Amherdt, M; Bednarek, SY; Hamamoto, S; Schekman, R; Yeung, T. . Cell. 1998-04-17, 93 (2): 263–75 [2020-02-12]. PMID 9568718. doi:10.1016/s0092-8674(00)81577-9.
- Saito, K; Katada, T. . Cellular and molecular life sciences : CMLS. 2015-10, 72 (19): 3709–20 [2020-02-12]. PMID 26082182. doi:10.1007/s00018-015-1952-9.
- Lord, C; Ferro-Novick, S; Miller, EA. . Cold Spring Harbor perspectives in biology. 2013-02-01, 5 (2) [2020-02-12]. PMID 23378591. doi:10.1101/cshperspect.a013367.
- Malhotra, V; Erlmann, P. . Annual review of cell and developmental biology. 2015, 31: 109–24 [2020-02-12]. PMID 26422332. doi:10.1146/annurev-cellbio-100913-013002.
- Khoriaty, R; Vasievich, MP; Ginsburg, D. . Blood. 2012-07-05, 120 (1): 31–8. PMID 22586181. doi:10.1182/blood-2012-01-292086.
- Deatherage, B. L.; Cookson, B. T. . Infection and Immunity. 2012, 80 (6): 1948–1957. ISSN 0019-9567. PMC 3370574. PMID 22409932. doi:10.1128/IAI.06014-11.
- Yáñez-Mó M, Siljander PR, Andreu Z, 等. . J Extracell Vesicles. 2015, 4: 27066. PMC 4433489. PMID 25979354. doi:10.3402/jev.v4.27066.
- Théry C, Witwer KW, Aikawa E, 等. . J Extracell Vesicles. 2018, 7 (1): 1535750. PMC 6322352. PMID 30637094. doi:10.1080/20013078.2018.1535750.
- Demory Beckler, M; Higginbotham, JN; Franklin, JL; Ham, AJ; Halvey, PJ; Imasuen, IE; Whitwell, C; Li, M; Liebler, DC; Coffey, RJ. . Molecular & cellular proteomics : MCP. 2013-02, 12 (2): 343–55 [2020-02-10]. PMID 23161513. doi:10.1074/mcp.M112.022806.
- Chiba, M; Kimura, M; Asari, S. . Oncology reports. 2012-11, 28 (5): 1551–8 [2020-02-10]. PMID 22895844. doi:10.3892/or.2012.1967.
- Simpson, RJ; Lim, JW; Moritz, RL; Mathivanan, S. . Expert review of proteomics. 2009-06, 6 (3): 267–83 [2020-02-10]. PMID 19489699. doi:10.1586/epr.09.17.
- Choi, DS; Park, JO; Jang, SC; Yoon, YJ; Jung, JW; Choi, DY; Kim, JW; Kang, JS; Park, J; Hwang, D; Lee, KH; Park, SH; Kim, YK; Desiderio, DM; Kim, KP; Gho, YS. . Proteomics. 2011-07, 11 (13): 2745–51 [2020-02-10]. PMID 21630462. doi:10.1002/pmic.201100022.
- George, JN; Thoi, LL; McManus, LM; Reimann, TA. . Blood. 1982-10, 60 (4): 834–40 [2020-02-11]. PMID 7115953.
- Martínez, MC; Tesse, A; Zobairi, F; Andriantsitohaina, R. . American journal of physiology. Heart and circulatory physiology. 2005-03, 288 (3): H1004–9 [2020-02-11]. PMID 15706036. doi:10.1152/ajpheart.00842.2004.
- 任寧; 陳樹濤; 郭緒昆. . 山東醫藥. 2013, (29): 90–92.
- 王喜梅; 楊躍進; 吳永健. . 醫學綜述. 2012, (13): 1993–1995.
- 虞宇楠; 宋浩明. . 國際心血管病雜誌. 2014, 41 (5): 300–303.
- Meldolesi, Jacopo. . Biochemistry & Molecular Biology Journal. 2016, 02 (01). doi:10.21767/2471-8084.100012.
- Anderson HC. . J. Cell Biol. 1967, 35 (1): 81–101. PMC 2107116. PMID 6061727. doi:10.1083/jcb.35.1.81.
- Bonucci E. . J. Ultrastruct. Res. 1967, 20 (1): 33–50. PMID 4195919. doi:10.1016/S0022-5320(67)80034-0.
- Bonderman, D; Teml, A; Jakowitsch, J; Adlbrecht, C; Gyöngyösi, M; Sperker, W; Lass, H; Mosgoeller, W; Glogar, DH; Probst, P; Maurer, G; Nemerson, Y; Lang, IM. . Blood. 2002-04-15, 99 (8): 2794–800 [2020-02-12]. PMID 11929768. doi:10.1182/blood.v99.8.2794. (原始内容存档于2020-03-03).
- Leroyer, AS; Isobe, H; Lesèche, G; Castier, Y; Wassef, M; Mallat, Z; Binder, BR; Tedgui, A; Boulanger, CM. . Journal of the American College of Cardiology. 2007-02-20, 49 (7): 772–7 [2020-02-12]. PMID 17306706. doi:10.1016/j.jacc.2006.10.053. (原始内容存档于2020-03-03).
- Wang, JG; Geddings, JE; Aleman, MM; Cardenas, JC; Chantrathammachart, P; Williams, JC; Kirchhofer, D; Bogdanov, VY; Bach, RR; Rak, J; Church, FC; Wolberg, AS; Pawlinski, R; Key, NS; Yeh, JJ; Mackman, N. . Blood. 2012-06-07, 119 (23): 5543–52 [2020-02-12]. PMID 22547577. doi:10.1182/blood-2012-01-402156. (原始内容存档于2020-03-03).
- Morel, O; Pereira, B; Averous, G; Faure, A; Jesel, L; Germain, P; Grunebaum, L; Ohlmann, P; Freyssinet, JM; Bareiss, P; Toti, F. . Atherosclerosis. 2009-06, 204 (2): 636–41 [2020-02-12]. PMID 19091315. doi:10.1016/j.atherosclerosis.2008.10.039. (原始内容存档于2020-03-03).
- Chiva-Blanch, G; Laake, K; Myhre, P; Bratseth, V; Arnesen, H; Solheim, S; Badimon, L; Seljeflot, I. . PloS one. 2017, 12 (2): e0172558 [2020-02-12]. PMID 28207887. doi:10.1371/journal.pone.0172558. (原始内容存档于2020-03-03).
- Świtońska, M; Słomka, A; Sinkiewicz, W; Żekanowska, E. . European journal of neurology. 2015-02, 22 (2): 395–401, e28–9 [2020-02-12]. PMID 25370815. doi:10.1111/ene.12591. (原始内容存档于2020-03-03).
- Wang, JG; Manly, D; Kirchhofer, D; Pawlinski, R; Mackman, N. . Journal of thrombosis and haemostasis : JTH. 2009-07, 7 (7): 1092–8 [2020-02-12]. PMID 19422446. doi:10.1111/j.1538-7836.2009.03448.x. (原始内容存档于2020-03-03).
- Słomka, A; Świtońska, M; Sinkiewicz, W; Żekanowska, E. . Annals of clinical biochemistry. 2017-05, 54 (3): 378–385 [2020-02-12]. PMID 27448592. doi:10.1177/0004563216663775. (原始内容存档于2020-03-03).
- WANG Xiao-xia; XIE Zi; ZHONG Wang-tao; MA Xiao-tang; PAN Qun-wen; XU Xiao-bing. . Hainan medical journal. 2019-04, 30 (7): 902–05. doi:10.3969/j.issn.1003-6350.2019.07.026.
- Pfeifer F. . Nature Reviews. Microbiology. 2012, 10 (10): 705–15. PMID 22941504. doi:10.1038/nrmicro2834.
- Walsby, Anthony. . Microbiological Reviews. March 1994, 58: 94–144. PMC 372955. PMID 8177173.
- Wilhelm, BG; Mandad, S; Truckenbrodt, S; Kröhnert, K; Schäfer, C; Rammner, B; Koo, SJ; Claßen, GA; Krauss, M; Haucke, V; Urlaub, H; Rizzoli, SO. . Science (New York, N.Y.). 2014-05-30, 344 (6187): 1023–8 [2020-02-08]. PMID 24876496. doi:10.1126/science.1252884. (原始内容存档于2020-03-03).
- Willig, KI; Rizzoli, SO; Westphal, V; Jahn, R; Hell, SW. . Nature. 2006-04-13, 440 (7086): 935–9 [2020-02-08]. PMID 16612384. doi:10.1038/nature04592. (原始内容存档于2020-03-03).
- Saviane, C; Silver, RA. . Nature. 2006-02-23, 439 (7079): 983–7 [2020-02-08]. PMID 16496000. doi:10.1038/nature04509. (原始内容存档于2020-03-03).
- QI Camaoji; SHA Zheng-Yue; LI Xian-Chan. . Chinese J. ANAL. CHEM. 2019, 47 (10): 1502-1511. doi:10.19756/j.issn.0253-3820.191443.
- Kawagoe, KT; Jankowski, JA; Wightman, RM. . Analytical chemistry. 1991-08-01, 63 (15): 1589–94 [2020-02-08]. PMID 1952084. doi:10.1021/ac00015a017. (原始内容存档于2020-03-03).
- Wightman, RM; Jankowski, JA; Kennedy, RT; Kawagoe, KT; Schroeder, TJ; Leszczyszyn, DJ; Near, JA; Diliberto EJ, Jr; Viveros, OH. . Proceedings of the National Academy of Sciences of the United States of America. 1991-12-01, 88 (23): 10754–8 [2020-02-08]. PMID 1961743. doi:10.1073/pnas.88.23.10754. (原始内容存档于2020-03-03).
- Finnegan, JM; Pihel, K; Cahill, PS; Huang, L; Zerby, SE; Ewing, AG; Kennedy, RT; Wightman, RM. . Journal of neurochemistry. 1996-05, 66 (5): 1914–23 [2020-02-08]. PMID 8780018. doi:10.1046/j.1471-4159.1996.66051914.x. (原始内容存档于2020-03-03).
- Li, YT; Zhang, SH; Wang, XY; Zhang, XW; Oleinick, AI; Svir, I; Amatore, C; Huang, WH. . Angewandte Chemie (International ed. in English). 2015-08-03, 54 (32): 9313–8 [2020-02-08]. PMID 26079517. doi:10.1002/anie.201503801. (原始内容存档于2020-03-03).
- Majdi, S; Berglund, EC; Dunevall, J; Oleinick, AI; Amatore, C; Krantz, DE; Ewing, AG. . Angewandte Chemie (International ed. in English). 2015-11-09, 54 (46): 13609–12 [2020-02-08]. PMID 26387683. doi:10.1002/anie.201506743. (原始内容存档于2020-03-03).
- Omiatek, DM; Santillo, MF; Heien, ML; Ewing, AG. . Analytical chemistry. 2009-03-15, 81 (6): 2294–302 [2020-02-08]. PMID 19228035. doi:10.1021/ac802466g. (原始内容存档于2020-03-03).
- Omiatek, DM; Dong, Y; Heien, ML; Ewing, AG. . ACS chemical neuroscience. 2010-03-17, 1 (3): 234–245 [2020-02-08]. PMID 20368748. doi:10.1021/cn900040e. (原始内容存档于2020-03-03).
- Omiatek, DM; Bressler, AJ; Cans, AS; Andrews, AM; Heien, ML; Ewing, AG. . Scientific reports. 2013, 3: 1447 [2020-02-08]. PMID 23486177. doi:10.1038/srep01447. (原始内容存档于2020-03-03).
- Dunevall, J; Fathali, H; Najafinobar, N; Lovric, J; Wigström, J; Cans, AS; Ewing, AG. . Journal of the American Chemical Society. 2015-04-08, 137 (13): 4344–6 [2020-02-08]. PMID 25811247. doi:10.1021/ja512972f. (原始内容存档于2020-03-03).
- Li, X; Majdi, S; Dunevall, J; Fathali, H; Ewing, AG. . Angewandte Chemie (International ed. in English). 2015-10-05, 54 (41): 11978–82 [2020-02-08]. PMID 26266819. doi:10.1002/anie.201504839. (原始内容存档于2020-03-03).
- Li, X; Dunevall, J; Ewing, AG. . Accounts of chemical research. 2016-10-18, 49 (10): 2347–2354 [2020-02-08]. PMID 27622924. doi:10.1021/acs.accounts.6b00331. (原始内容存档于2020-03-03).
- Lebègue, E; Anderson, CM; Dick, JE; Webb, LJ; Bard, AJ. . Langmuir : the ACS journal of surfaces and colloids. 2015-10-27, 31 (42): 11734–9 [2020-02-08]. PMID 26474107. doi:10.1021/acs.langmuir.5b03123. (原始内容存档于2020-03-03).
- Li, X; Dunevall, J; Ren, L; Ewing, AG. . Analytical chemistry. 2017-09-05, 89 (17): 9416–9423 [2020-02-08]. PMID 28776974. doi:10.1021/acs.analchem.7b02226. (原始内容存档于2020-03-03).
- Li, X; Ren, L; Dunevall, J; Ye, D; White, HS; Edwards, MA; Ewing, AG. . ACS nano. 2018-03-27, 12 (3): 3010–3019 [2020-02-08]. PMID 29513514. doi:10.1021/acsnano.8b00781. (原始内容存档于2020-03-03).
- Lovrić, J; Najafinobar, N; Dunevall, J; Majdi, S; Svir, I; Oleinick, A; Amatore, C; Ewing, AG. . Faraday discussions. 2016-12-12, 193: 65–79 [2020-02-08]. PMID 27711871. doi:10.1039/c6fd00102e. (原始内容存档于2020-03-03).
- Li, Xianchan; Dunevall, Johan; Ewing, Andrew G. . Faraday Discussions. 2018, 210: 353–364. doi:10.1039/C8FD00020D.
- Phan, Nhu T. N.; Li, Xianchan; Ewing, Andrew G. . Nature Reviews Chemistry. 2017-06-07, 1 (6). doi:10.1038/s41570-017-0048.
- Ren, L; Mellander, LJ; Keighron, J; Cans, AS; Kurczy, ME; Svir, I; Oleinick, A; Amatore, C; Ewing, AG. . Quarterly reviews of biophysics. 2016-01, 49: e12 [2020-02-09]. PMID 27659043. doi:10.1017/S0033583516000081. (原始内容存档于2020-03-03).
- Mohammadi, AS; Li, X; Ewing, AG. . Analytical chemistry. 2018-07-17, 90 (14): 8509–8516 [2020-02-09]. PMID 29912552. doi:10.1021/acs.analchem.8b01395. (原始内容存档于2020-03-03).
- Ye, Daixin; Ewing, Andrew. . ChemPhysChem. 2018-05-22, 19 (10): 1119–1119. doi:10.1002/cphc.201800404.
- Ye, Daixin; Gu, Chaoyi; Ewing, Andrew. . ACS Chemical Neuroscience. 2018-07-06, 9 (12): 2941–2947. doi:10.1021/acschemneuro.8b00130.