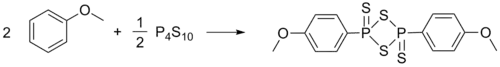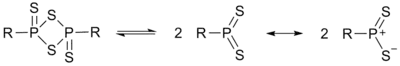劳森试剂
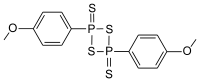
劳森试剂(Lawesson试剂、LR),也称劳氏试剂,是常用于制取有机硫化合物的一个化学试剂。它是微黄色的固体粉末,具有强烈难闻的腐烂气味。1956年首先由芳烃与十硫化四磷反应制得。[1]瑞典化学家Sven-Olov Lawesson仔细研究了其与有机化合物的反应,使其应用大大推广,因此名称也由此得来。[2]
| 劳森试剂 | |
|---|---|
 | |
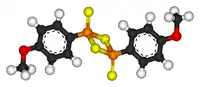 | |
| IUPAC名 2,4-bis(4-methoxyphenyl)- 1,3,2,4-dithiadiphosphetane 2,4-disulfide | |
| 别名 | Lawesson试剂、LR、 劳氏试剂 |
| 识别 | |
| CAS号 | 19172-47-5 |
| SMILES |
|
| 性质 | |
| 化学式 | C14H14O2P2S4 |
| 摩尔质量 | 404.47 g·mol⁻¹ |
| 外观 | 微黄色粉末 |
| 熔点 | 228 - 231 °C |
| 溶解性(水) | 不可溶 |
| 危险性 | |
| 警示术语 | R:R15/29, R20/21/22 |
| 安全术语 | S:S22, S45, S7/8 |
| 欧盟分类 | 刺激物 有害 (XN) |
| 相关物质 | |
| 相关硫化试剂 | 硫化氢、十硫化四磷 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
劳森试剂是一个氧硫交换试剂,最常见的应用是硫代酰胺的制取。
制备
将十硫化四磷(五硫化二磷)与苯甲醚混合,加热回流反应。至反应液澄清,不再有硫化氢产生时,[3]冷却,将晶体过滤并在甲苯或二甲苯中重结晶,便得到劳森试剂。
该试剂具有强烈难闻的气味。制备反应应当于通风橱中进行。反应后的器具用次氯酸钠洗涤。
机理
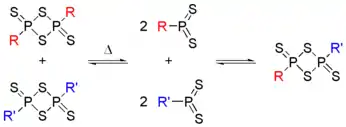
劳森试剂的分子含有硫和磷交替组成的四元环结构。加热时发生解聚,生成两个不稳定的硫代磷叶立德(R-PS2),它们是主要的反应活性中间体。用两个取代基不同的劳森试剂反应时,在产物的31P NMR谱中观测到了取代基发生互换的分子,因此证实了中间体R-PS2的存在。
应用
劳森试剂是一个氧硫交换试剂,其最常用的用途是将羰基化合物转化为硫羰基化合物,可以反应的底物包括酮[4]、酯[5]、内酯[6]、酰胺、内酰胺[7]、醌等。富电子的羰基更容易反应。与α,β-不饱和醛酮反应时,双键不受影响。

酮与Lawesson试剂作用发生硫化生成硫酮
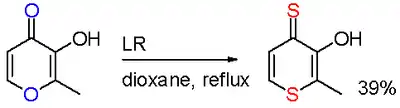
劳森试剂与麦芽酚反应
其他:
- 脂肪族、芳香族和杂环芳香一级酰胺都可较好地与劳森试剂反应。十硫化四磷也是常用的硫化试剂,但它的使用有时会使酰胺分解产生腈和硫化氢,从而使反应产率降低;
- 高氯酸银与劳森试剂的混合物可以用作亲氧的路易斯酸,催化二烯烃与α,β-不饱和醛的狄尔斯-阿尔德反应;
- 1,4-二酮与劳森试剂反应环化为噻吩。用十硫化四磷也可以反应,但反应需要的温度更高;
- 劳森试剂与亚砜反应生成硫代产物,然后脱硫生成硫醚。因此可作亚砜的还原剂;
- 劳森试剂与苯环上邻位连有羟基或氨基的酰胺反应产率不高,原因是生成了如下的副产物。该反应可用于硫代单烷基膦酸酯类化合物的制取:
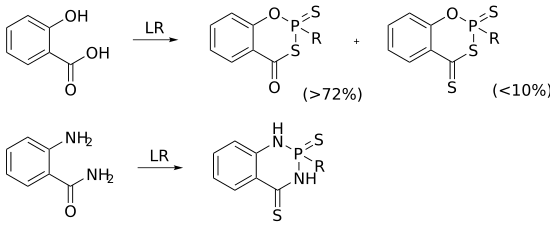
劳森试剂制取有机磷化合物
相关试剂
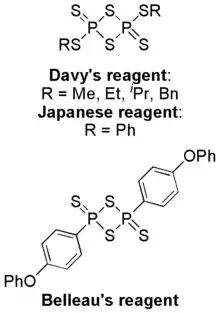
与劳森试剂相关的化合物。它们全部具有1,3-二硫-2,4-二磷杂环丁烷-2,4二硫化物结构。
很多类似于劳森试剂的化合物都已经制得,它们比劳森试剂更容易使用,反应条件温和,产率也比较高。甲氧基苯基被烷基(如甲基、乙基、异丙基、丁基)硫基取代后,形成的试剂称为Davy试剂(DR),[13]取代基为苯基硫基时称为Japanese试剂(JR),[14]为对苯氧基苯基时称为Belleau试剂(BR)。[15]它们都可由相应的硫醇与十硫化四磷制备。
参考资料
- Lecher, H. Z.; Greenwood, R. A.; Whitehouse, K. C.; Chao, T. H. . J. Am. Chem. Soc. 1956, 78: 5018. doi:10.1021/ja01600a058.
- Pedersen B. S., Scheibye S., Nilson N, H,, Lawesson S. O. . Bulletin des Societes Chimiques Belges. 1978, 87 (3): 223–228.
- Thomsen, I.; Clausen, K.; Scheibye, S.; Lawesson, S.-O. (1990). "Thiation with 2,4-Bis(4-methoxyphenyl)-1,3,2,4-Dithiadiphosphetane 2,4-disulfide: N-Methylthiopyrrolidone". Org. Synth.; Coll. Vol. 7: 372.
- Pedersen, B. S.; Scheibye, S.; Nilsson, N. H.; Lawesson, S.-O. Bull. Soc. Chim. Belg. 1978, (87): 223. 缺少或
|title=为空 (帮助) - Jones, B. A.; Bradshaw, J. S. . Chem. Rev. (Review). 1984, 84 (84): 17. doi:10.1021/cr00059a002.
- Scheibye, S.; Kristensen, J.; Lawesson, S.-O. . Tetrahedron. 1979, 35 (35): 1339. doi:10.1016/0040-4020(79)85027-9.
- Shabana, R.; Scheibye, S.; Clausen, K.; Olesen, S. O.; Lawesson, S.-O. Nouv. J. Chim. 1980, (4): 47. 缺少或
|title=为空 (帮助) - Cherkasov, R. A.; Kutyrev, G. A.; Pudovik, A. N. . Tetrahedron (Review). 1985, 41 (41): 2567. doi:10.1016/S0040-4020(01)96363-X.
- Foreman, M.S.; Woollins, J.D. . J. Chem. Soc., Dalton Trans. 2000: 1533–1543. doi:10.1039/b000620n.
- Martin Jesberger, Thomas P. Davis, Leonie Barner. . Synthesis (Review). 2003, 2003: 1929–1958. doi:10.1055/s-2003-41447.
- Cava, M. P.; Levinson, M. I. . Tetrahedron. 1985, 41 (22): 5061–5087. doi:10.1016/S0040-4020(01)96753-5.
- Daniel Brayton, Faith E. Jacobsen, Seth M. Cohen and Patrick J. Farmer. . Chemical Communications. 2006, 2006: 206–208. doi:10.1039/b511966a.
- Davy, H. Sulfur Lett. 1985, 3, 39.
- Yokoyama, M.; Hasegawa, Y.; Hatanaka, H.; Kawazoe, Y.; Imamoto, T. Synthesis 1984, 827–828. DOI: 10.1055/s-1984-30980
- Lajoie, G.; Lépine, F.; Maziak, L.; Belleau, B. Tetrahedron Lett. 1983, 24, 3815–3818. DOI: 10.1016/S0040-4039(00)94282-5
外部链接
- “劳森试剂”于organic-chemistry.org
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.