冷却浴
在有机化学中,冷却浴(英語:)是一种通过调配液态混合物的冷冻剂提供和维持低温环境的实验技术,冷却浴所能提供的温度范围通常为13至-196℃。它常用于需要在低于室温下进行的反应和实验处理步骤,通常这些反应和处理操作是放热的或是会涉及热不稳定的中间体或产物。冷却浴所用的冷却剂包括干冰、液氮 和碎冰块。
产生和维持低温的方法
产生和维持低温的方法主要有三种:冰盐浴(ice-salt baths)[1][2]、干冰-溶剂浴(dry ice-solvent baths)[3][4]和液氮-雪泥浴(liquid nitrogen slush baths)[5][6][7]。
| 溶剂 | 温度(℃) | 溶剂 | 温度(℃) |
|---|---|---|---|
| 对二甲苯 | 13±1[7] | 乙酸乙酯 | -84[7] |
| 1,4-二氧六环 | 12[7] | 正己基溴 | -85[7] |
| 环己烷 | 6[7] | 甲基乙基酮 | -86[7] |
| 苯 | 5[7] | 丙烯醛 | -88[7] |
| 甲酰胺 | 2[7] | 戊基溴 | -88[7] |
| 苯胺 | -6[7] | 正丁醇* | -89[7] |
| 乙二醇* | -10[7] | 叔丁醇* | -89[7] |
| 环庚烷 | -12[7] | 异丙醇* | -89[7] |
| 苯甲酸甲酯 | -12[7] | 硝基乙烷 | -90[7] |
| 苯甲腈 | -13[7] | 庚烷 | -91[7] |
| 苯甲醇 | -15[7] | 醋酸正丙酯 | -92[7] |
| 炔丙醇 | -17[7] | 2-硝基丙烷 | -93[7] |
| 邻二氯苯 | -18[7] | 环戊烷 | -93[7] |
| 四氯乙烷 | -22[7] | 乙苯 | -94[7] |
| 四氯化碳 | -23[7] | 己烷 | -94[7] |
| 间二氯苯 | -25[7] | 甲苯 | -95[7] |
| 硝基乙烷 | -29[7] | 异丙苯 | -97[7] |
| 邻二甲苯 | -29[7] | 甲醇 | -98[7] |
| 溴苯 | -30[7] | 乙酸甲酯 | -98[7] |
| 碘苯 | -31[7] | 乙酸异丁酯 | -99[7] |
| 间甲基苯胺 | -32[7] | 戊基溴 | -99[7] |
| 噻吩 | -38[7] | 丁醛 | -99[7] |
| 乙腈 | -41[7] | 丙基碘 | -101[7] |
| 吡啶 | -42[7] | 丁基碘 | -103[7] |
| 溴化苄 | -43[7] | 环己烷 | -104[7] |
| 环己基溴 | -44[7] | 叔丁基胺 | -105[7] |
| 氯苯 | -45[7] | 异辛烷 | -107[7] |
| 间二甲苯 | -47[7] | 1-硝基丙烷 | -108[7] |
| 正丁基胺 | -50[7] | 碘乙烷 | -109[7][8] |
| 乙酸苄酯 | -52[7] | 丙基溴 | -110[7] |
| 正辛烷 | -56[7] | 二硫化碳 | -110[7] |
| 氯仿 | -63[7] | 丁基溴 | -112[7] |
| 碘甲烷 | -66[7] | 乙醇* | -116[7] |
| 叔丁基胺 | -68[7] | 异戊醇* | -117[7] |
| 三氯乙烯 | -73[7] | 溴乙烷 | -119[7] |
| 乙酸异丙酯 | -73[7] | 氯丙烷 | -123[7] |
| 2-甲基异丙基苯 | -74[7] | 丁基氯 | -123[7] |
| 4-甲基异丙基苯 | -73[7] | 乙醛 | -124[7] |
| 乙酸丁酯 | -77[7] | 甲基环己烷 | -126[7] |
| 醋酸异戊酯 | -79[7] | 正丙醇* | -127[7] |
| 丙烯腈 | -82[7] | 正戊烷 | -131[7] |
| 正己基氯 | -83[7] | 1,5-己二烯 | -141[7] |
| 丙胺 | -83[7] | 异戊烷 | -160[7] |
液氮雪泥浴
通过把液氮小心地加到不断搅拌的某种有机溶剂中来调配呈冰淇淋状的液氮雪泥浴,同时用玻璃棒搅拌能避免液氮雪泥浴局部固化。 液氮雪泥浴能实现的温度范围是从13至-196℃。一般在使用杜瓦瓶能达到较好保温条件的情况下,液氮雪泥浴可维持数个小时。但如果反应需要维持更长时间的低温比如需要过夜反应时,有必要使用制冷机、循环冷凝机或冰箱等机械制冷手段来维持长时间的低温。液氮雪泥浴特别适用于给反应溶剂脱气[8]和减压蒸馏时馏分的冷凝收集。
冰盐冷却浴
常压下冰水混合物的温度为0℃,将盐的浓溶液与碎冰搅拌混合得到的由冰和盐水构成的冷却浴能产生并维持低于0℃的温度效果。改变盐溶液的浓度能调节冷却浴能维持的稳态温度,不同种类的盐能实现的冷却浴最低温度也各不相同,实践中能得到并维持的温度范围通常在0至-51℃之间(详见下表)。但是当盐溶液上升到一定浓度后,原先呈冰水混合物状态的冰盐冷却浴会因达到共晶温度(Eutectic temperature)而全部凝结形成颗粒状的冰盐粒子[1],这样就使得浸没在其中的实验装置接触导热面积变小,不利于热量的及时扩散。
| 盐 | 盐溶液 (g无水盐/100g水) | 温度(℃) | 盐 | 盐溶液 (g无水盐/100g水) | 温度(℃) |
|---|---|---|---|---|---|
| NaCl | 6.11 | -3.48[1] | NH4Cl | 9.28 | -5.73[1] |
| NaCl | 8.93 | -5.17[1] | NH4Cl | 12.27 | -7.63[1] |
| NaCl | 10.77 | -6.32[1] | NH4Cl | 12.56 | -7.80[1] |
| NaCl | 14.20 | -8.52[1] | NH4Cl | 13.76 | -8.60[1] |
| NaCl | 15.46 | -9.41[1] | NH4Cl | 16.89 | -10.58[1] |
| NaCl | 17.87 | -11.04[1] | NH4Cl | 18.80 | -11.80[1] |
| NaCl | 22.25 | -14.33[1] | NH4Cl | 19.94 | -12.44[1] |
| NaCl | 22.99 | -14.77[1] | NH4Cl | 19.93 | -12.60[1] |
| NaCl | 24.75 | -16.21[1] | NH4Cl | 22.40 | -14.03[1] |
| NaCl | 27.70 | -18.73[1] | NH4Cl | 24.13 | -15.10[1] |
| NaCl | 29.70 | -20.56[1] | NH4Cl | 24.50 | -15.36[1] |
| NaCl | 30.4 | -21.12[1] | |||
| KCl | 7.09 | -3.07[1] | |||
| KCl | 10.77 | -4.66[1] | |||
| KCl | 17.38 | -7.51[1] | |||
| KCl | 22.69 | -9.84[1] | |||
| KCl | 23.80 | -10.34[1] | |||
| KCl | 24.60 | -10.66[1] | |||
干冰溶剂冷却浴
干冰即固体的二氧化碳有粒状和棒状的商品可供购买,它与多种溶剂都能形成有良好冷却效果的混合物(详见表2)。干冰溶剂浴的配制和维持方法简单可靠,一般是将粒状的干冰一颗颗的小心加入到所需溶剂中直至有包覆着冻结溶剂的干冰块出现为止,此时冷却浴温度已至所能达到的稳态温度(Steady state temperature),之后只需每间隔一定时间补充块状干冰并加以搅动就能保持温度[3];且干冰溶剂浴的温度重现性较好,稳态温度的变化能控制在±1℃的幅度内[3]。
溶剂纯度对干冰溶剂浴的影响较大。一个典型的例子就是使用分析纯的乙腈调制的干冰乙腈浴稳态温度是-42°C,但当分析纯的乙腈中混有0-3%的丙烯腈时冷却浴的稳态温度会从-42降至-51℃,而用工业级(Technical grade)乙腈调制的干冰乙腈浴稳态温度为-42℃且这个温度效果是可重复的[3]。
| 溶剂 | 温度(℃) | 溶剂 | 溶剂(℃) |
|---|---|---|---|
| 乙二醇 | -12[4] | 异丙醚 | -60 |
| 四氯化碳 | -23[3] | 氯仿 | -61[3] |
| 3-庚酮 | -38[3] | 乙醇 | -78[4] |
| 工业级乙腈 | -46[3] | 丙酮 | -78[3] |
| 分析纯乙腈 | -42[3] |
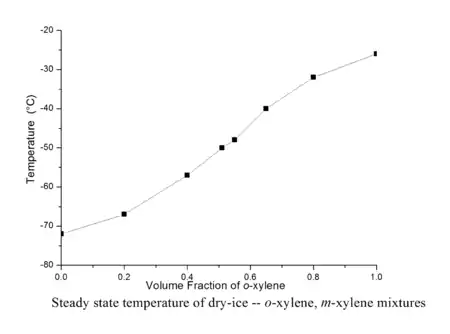
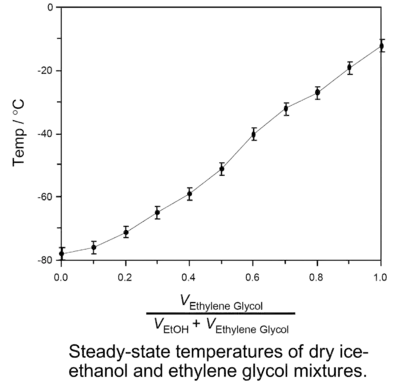
配制干冰溶剂浴不仅可以使用单一的纯溶剂,也可使用由两种溶剂互溶后配制的混合溶剂,使用混合溶剂时可通过调节两种溶剂的比例来调节所需干冰溶剂浴的稳态温度,比如纯的邻二甲苯由于熔点只有-26℃,所以与干冰混合制成的冷却浴稳态温度为-26℃且呈粘稠的淤泥状,但使用邻二甲苯和间二甲苯的混合溶液制作的干冰溶剂浴不仅粘度小,而且还可通过调节邻二甲苯和间二甲苯的体积比来近似线性地调节冷却浴的温度(见左下图),温度的变化范围从-26°C至-72℃[3];另一种可以使用的混合溶剂体系是由乙二醇和乙醇组成的,通过调节乙二醇和乙醇的比例能近似线性地调节温度,配制的冷却浴温度变化范围是从-12℃至-78 ℃(见右下图),只需要定时补充部分干冰它就能可靠地维持恒定温度至多5小时[4]。
参考文献
- Worth H. Rodebush. . J. Am. Chem. Soc. 1918, 40 (8): 1204–1213 [2012-08-29]. doi:10.1021/ja02241a008. (原始内容存档于2015-03-30).(英文)
- Wilbam P. Bryan and Robert H. Byrne. . J. Chem. Educ. 1970, 47 (5): 361. doi:10.1021/ed047p361.(英文)
- Alan M. Phipps and David N. Hume. . J. Chem. Educ. 1968, 45 (10): 664. doi:10.1021/ed045p664.(英文)
- Craig M. Jensen and Do W. Lee. . J. Chem. Educ. 2000, 77 (5): 629 [2012-08-26]. doi:10.1021/ed077p629. (原始内容存档于2016-04-21).(英文)
- Ronald C. Blatchley. . J. Chem. Educ. 1997, 74 (6): 616. doi:10.1021/ed074p616.4.(英文)
- William T. Nolan and Thaddeus J. Gish. . J. Chem. Educ. 1997, 74 (6): 617. doi:10.1021/ed074p617.(英文)
- Roger E. Rondeau. . J. Chem. Eng. Data. 1966, 11 (1): 124–124. doi:10.1021/je60028a037.(英文)
- R. E. Rondeau , L. A. Harrah. . J. Chem. Eng. Data. 1965, 10 (1): 84–85. doi:10.1021/je60024a031.(英文)

