反苯环丙胺
反苯环丙胺(Tranylcypromine,原商品名Parnate)是一种单胺氧化酶(MAO)的非选择性和不可逆性抑制剂(MAOI),[2]其属于苯乙胺和安非他命类。临床上用于治疗重度抑郁症、焦虑症和强迫症。
 | |
 | |
| 系统(IUPAC)命名名称 | |
|---|---|
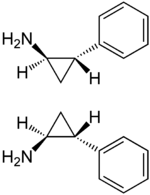
(±)-trans-2-phenylcyclopropyl-1-amine | |
| 临床数据 | |
| 妊娠分级 |
|
| 给药途径 | 口服 |
| 药代动力学数据 | |
| 生物利用度 | 50%[1] |
| 代谢 | 肝脏(被CYP2A6、CYP2C19、CYP2D6、MAOA和MAOB催化) |
| 生物半衰期 | 2.5小时[1] |
| 排泄 | 尿液、粪便[1] |
| 识别 | |
| CAS注册号 | 155-09-9 |
| ATC代码 | N06AF04 |
| PubChem | CID 19493 |
| DrugBank | DB00752 |
| ChemSpider | 18369 |
| UNII | 3E3V44J4Z9 |
| KEGG | D08625 |
| ChEBI | CHEBI:9652 |
| ChEMBL | CHEMBL1179 |
| 化学 | |
| 化学式 | C9H11N |
| 摩尔质量 | 133.19 g/mol |
| |
医疗用途
反苯环丙胺用于治疗重性抑郁障碍,包括非典型抑郁,尤其是在共病焦虑时,反苯环丙胺一般作为二线选择。[3]它也可用于对再摄取抑制剂抗抑郁药(例如SSRI、SNRI、TCA、NDRI)没有反应的抑郁症。[4]
禁忌症
不良反应
非常常见(发生率>10%)的不良反应包括:
- 继发于体位性低血压的眩晕(17%)
常见(1-10%发生率)不良反应包括:
- 心动过速(5-10%)
- 轻躁狂(7%)
- 消瘦(2%)
- 慌乱(2%)
- 口干(2%)
- 性功能障碍(2%)
- 高血压(摄入后1~2小时)(2%)
- 皮疹(2%)
- 尿储留(2%)
其他(发生率未知)不良反应包括:
- 食欲增加/减少
- 血液恶液质
- 胸痛
- 腹泻
- 浮肿
- 幻觉
- 反射亢进
- 失眠
- 黄疸
- 腿抽筋
- 肌痛
- 心悸
- 感觉寒冷
- 自杀意念
- 颤抖
值得注意的是,尚未发现性别与65岁之下的年龄相关的不良反应发生率的相关性。[11]
与肼类MAOI相比,反苯环丙胺与体重增加无关,并且具有较低的肝毒性风险。[6][10]通常建议在麻醉前停用MAOI,但这会增加抑郁复发的风险。在一项回顾性观察性队列研究中发现接受全麻的使用反苯环丙胺的患者术中低血压的发生率较低,与未使用MAOI治疗的患者的心动过缓、心动过速和高血压的发生率没有差异。[12]使用间接拟交感神经药物或影响5-羟色胺再摄取的药物,如哌替啶或右美沙芬,分别会导致高血压和5-羟色胺综合征的风险,建议使用替代药物。[13][14]其他的研究得到了同样的结论[10]鉴于反苯环丙胺是CYP2A6的高亲和力底物并且在治疗浓度下不抑制CYP酶,因此不太可能与麻醉剂发生药代动力学的相互作用。[2]
据报道,反苯环丙胺的滥用者会每天摄入120~600mg的反苯环丙胺。[5][10][15]据认为高剂量的反苯环丙胺会有更强的安非他命样效果。起效迅速和短暂的半衰期加剧了反苯环丙胺的滥用。[10]
据报道,有在使用反苯环丙胺治疗的过程中,或停药早期,存在自杀观念或自杀想法的病例。
反苯环丙胺过量的症状通常是其常见作用的更强烈表现。[5]
相互作用
除了禁忌的联合用药,反苯环丙胺还能抑制CYP2A6,这可能会抑制这种酶的底物的代谢并增加其毒性,例如:[9]
去甲肾上腺素再摄取抑制剂(NRI)可以防止神经元对酪胺的摄取,并可降低其升高血压的作用。
药理学
药效学
反苯环丙胺作为MAO的非选择性和不可逆的抑制剂而发挥作用。[16]对于MAO的亚型,相对于对MAO-A而言,其对MAO-B略有偏好。[8]这导致单胺类如5-羟色胺、去甲肾上腺素和多巴胺的可用性增加,而且痕量胺例如色胺、章鱼胺和苯乙胺的可用性显著增加。[8][9]
在较高剂量下,它可以充当去甲肾上腺素再摄取抑制剂。[8]与苯丙胺相比,反苯环丙胺作为多巴胺释放剂的效力相对较低,对促进去甲肾上腺素和5-羟色胺释放的的效力甚至更低。[8][9]
反苯环丙胺也被证明可以抑制组蛋白去甲基化酶BHC110/LSD1,反苯环丙胺组蛋白去甲基化酶抑制的IC50<2μm,因此它可发挥组蛋白去甲基化的小分子抑制剂的作用,有降低BHC110/LSD1靶基因转录活性的作用。[17]这种效应的临床相关性尚不清楚。
已发现反苯环丙胺以纳摩尔浓度抑制CYP46A1。这种效应的临床相关性尚不清楚。[18]
合成
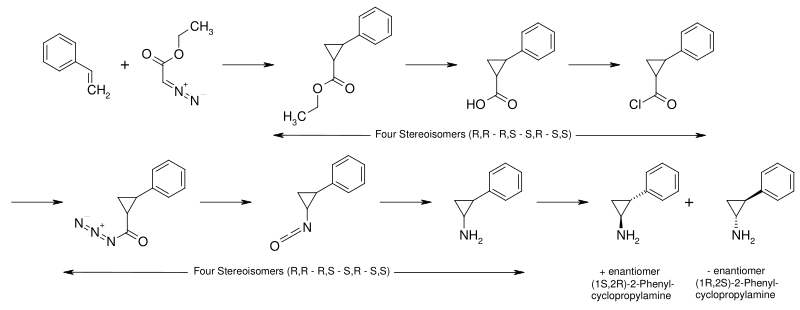
反苯环丙胺是安非他命的环丙基类似物。它可以通过如下路线制取:[20][21]
- 苯乙烯与重氮乙酸乙酯反应生成2-苯基环丙烷甲酸乙酯。
- 2-苯基环丙烷甲酸乙酯在碱存在下水解生成2-苯基环丙烷甲酸。
- 2-苯基环丙烷甲酸与氯化亚砜反应生成2-苯基环丙烷甲酰氯。
- 2-苯基环丙烷甲酰氯与叠氮化钠反应,氯被叠氮基取代,生成酰基叠氮。
- 酰基叠氮发生Curtius重排反应生成异氰酸酯。
- 异氰酸酯经Schmidt反应水解为2-苯基环丙胺,即反苯环丙胺。
此时得到的是四种立体异构体的混合物。通过与手性的酒石酸结晶拆分,即可得到所需的(1S,2R)-和(1R,2S)-反式-2-苯基环丙胺两种异构体的混合物。
参考资料
- Williams, David A. . Foye, William O.; Lemke, Thomas L.; Williams, David A. (编). . Hagerstwon, MD: Lippincott Williams & Wilkins. 2007: 590–1 [2009-09-03]. ISBN 0-7817-6879-9. (原始内容存档于2017-09-08).
- Ulrich, Sven; Ricken, Roland; Adli, Mazda. . European Neuropsychopharmacology: The Journal of the European College of Neuropsychopharmacology. 08 2017, 27 (8): 697–713 [2018-10-17]. ISSN 1873-7862. PMID 28655495. doi:10.1016/j.euroneuro.2017.05.007. (原始内容存档于2018-10-17).
- . Drugs of the Future. 2015, 40 (11): 771. ISSN 0377-8282. doi:10.1358/dof.2015.040.11.2413472.
- Riederer, P; Laux, G (March 2011). . Experimental Neurobiology. 2011,. 20 (1): 1 (1): 17. ISSN 1226-2560. PMC 3213739. PMID 22110357. doi:10.5607/en.2011.20.1.1 (英语).
- UK Electronic medicines compendium. Tranylcypromine 页面存档备份,存于
- Riederer, P; Laux, G (March 2011). "MAO-inhibitors in Parkinson's Disease". Experimental Neurobiology. 20 (1): 1–17. doi:10.5607/en.2011.20.1.1. PMC 3213739. PMID 22110357.
- Gillman, PK (February 2011). "Advances pertaining to the pharmacology and interactions of irreversible nonselective monoamine oxidase inhibitors". Journal of Clinical Psychopharmacology. 31 (1): 66–74.
- Ulrich, S; Ricken, R; Adli, M (August 2017). "Tranylcypromine in mind (Part I): Review of pharmacology". European Neuropsychopharmacology. 27 (8): 697–713. doi:10.1016/j.euroneuro.2017.05.007. PMID 28655495.
- Gillman, PK (February 2011). "Advances pertaining to the pharmacology and interactions of irreversible nonselective monoamine oxidase inhibitors". Journal of Clinical Psychopharmacology. 31 (1): 66–74. doi:10.1097/JCP.0b013e31820469ea. PMID 21192146.
- Ricken, R; Ulrich, S; Schlattmann, P; Adli, M (August 2017). "Tranylcypromine in mind (Part II): Review of clinical pharmacology and meta-analysis of controlled studies in depression". European Neuropsychopharmacology. 27 (8): 714–731. doi:10.1016/j.euroneuro.2017.04.003. PMID 28579071.
- Ricken, R; Ulrich, S; Schlattmann, P; Adli, M (August 2017). "Tranylcypromine in mind (Part II): Review of clinical pharmacology and meta-analysis of controlled studies in depression". European Neuropsychopharmacology. 27 (8): 714–731. doi:10.1016/j.euroneuro.2017.04.003. PMID 28579071.
- van Haelst, IM; van Klei, WA; Doodeman, HJ; Kalkman, CJ; Egberts, TC; MAOI Study, Group. (August 2012). "Antidepressive treatment with monoamine oxidase inhibitors and the occurrence of intraoperative hemodynamic events: a retrospective observational cohort study". The Journal of Clinical Psychiatry. 73 (8): 1103–9. doi:10.4088/JCP.11m07607. PMID 22938842.
- Smith, MS; Muir, H; Hall, R (February 1996). "Perioperative management of drug therapy, clinical considerations". Drugs. 51 (2): 238–59. doi:10.2165/00003495-199651020-00005. PMID 8808166.
- Blom-Peters, L; Lamy, M (1993). "Monoamine oxidase inhibitors and anesthesia: an updated literature review". Acta Anaesthesiologica Belgica. 44 (2): 57–60. PMID 8237297.
- Le Gassicke, J; Ashcroft, GW; Eccleston, D; Evans, JI; Oswald, I; Ritson, EB (1 April 1965). "The Clinical State, Sleep and Amine Metabolism of a Tranylcypromine ('Parnate') Addict". The British Journal of Psychiatry. 111 (473): 357–364. doi:10.1192/bjp.111.473.357.
- Williams, David A. (2007). "Antidepressants". In Foye, William O.; Lemke, Thomas L.; Williams, David A. Foye's Principles of Medicinal Chemistry. Hagerstwon, USA: Lippincott Williams & Wilkins. pp. 590–1. ISBN 978-0-7817-6879-5.
- Lee, MG; Wynder, C; Schmidt, DM; McCafferty, DG; Shiekhattar, R (June 2006). "Histone H3 lysine 4 demethylation is a target of nonselective antidepressive medications". Chemistry & Biology. 13 (6): 563–7.
- Mast, N; Charvet, C; Pikuleva, IA; Stout, CD (8 October 2010). "Structural basis of drug binding to CYP46A1, an enzyme that controls cholesterol turnover in the brain". The Journal of Biological Chemistry. 285 (41): 31783–95. doi:10.1074/jbc.M110.143313. PMC 2951250. PMID 20667828
- Sherry, RL; Rauw, G; McKenna, KF; Paetsch, PR; Coutts, RT; Baker, GB (December 2000). "Failure to detect amphetamine or 1-amino-3-phenylpropane in humans or rats receiving the MAO inhibitor tranylcypromine". Journal of Affective Disorders. 61 (1–2): 23–9. doi:10.1016/s0165-0327(99)00188-3. PMID 11099737.
- V.J. Rajadhyaksha, US Patent 4016204 (1977).
- A. Burger, W.L.L. Yost. J. Am. Chem. Soc. 1948, 70: 2198. doi:10.1021/ja01186a062. 缺少或
|title=为空 (帮助)