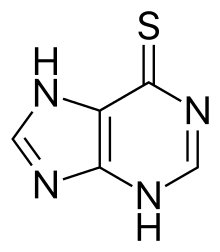
巯嘌呤
巯嘌呤(英語:,简称6-MP,又名6-巯基嘌呤、巯基嘌呤或巯唑嘌呤)是一种硫嘌呤类化疗药物和免疫抑制剂。[1]
 | |
| 系统(IUPAC)命名名称 | |
|---|---|
3,7-dihydropurine-6-thione | |
| 临床数据 | |
| 商品名 | Purinethol |
| Drugs.com | Monograph |
| MedlinePlus | a682653 |
| 妊娠分级 |
|
| 给药途径 | 口服 |
| 合法狀態 | |
| 合法状态 |
|
| 药代动力学数据 | |
| 生物利用度 | 5~37% |
| 代谢 | 黄嘌呤氧化酶 |
| 生物半衰期 | 60至120分钟,活性代谢产物则更长 |
| 排泄 | 肾脏 |
| 识别 | |
| CAS注册号 | 50-44-2 |
| ATC代码 | L01BB02 |
| PubChem | CID 667490 |
| DrugBank | DB01033 |
| ChemSpider | 580869 |
| UNII | PKK6MUZ20G |
| KEGG | D04931 |
| ChEBI | CHEBI:50667 |
| ChEMBL | CHEMBL1425 |
| 化学 | |
| 化学式 | C5H4N4S |
| 摩尔质量 | 152.177 g/mol |
| |
| |
历史
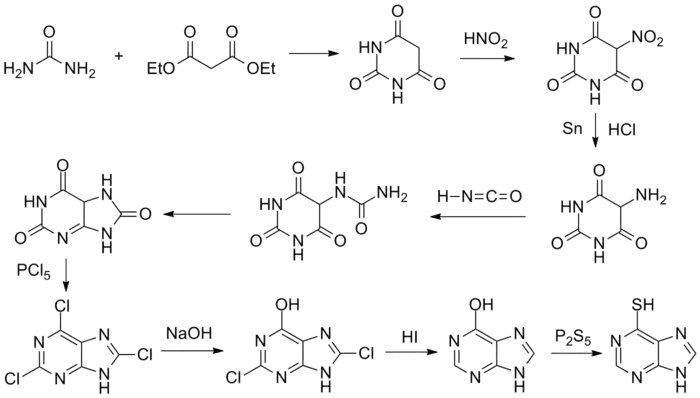
1951年,格特鲁德·B·埃利恩和喬治·H·希欽斯用干酪乳杆菌试验了100多种嘌呤类似物,其中亦包括了巯嘌呤。[2] 他们发现,这种物质是很强的嘌呤拮抗剂,于是开始在小鼠与白血病患者上进行临床试验,并大获成功。[3][4] 美国食品和药品管理局(FDA)在1953年批准了巯嘌呤上市——此时巯嘌呤被合成出来仅两年时间,而临床试验更是只进行了十个月。
用途
巯嘌呤主要用于急性白血病(包括急性粒细胞白血病和急性淋巴细胞白血病)的维持治疗,[5] 同时也被用于治疗恶性葡萄胎、绒毛膜上皮癌、[6] 真红细胞增多症、[7] 银屑病关节炎、[8] 和炎症性肠炎(如克罗恩病和溃疡性结肠炎)。[9]
有研究显示巯嘌呤在体外具有抗副结核分枝杆菌(Mycobacterium paratuberculosis)的活性。[10]
作用机理
巯嘌呤是一种嘌呤类似物,属于嘌呤拮抗剂类抗代谢物。[5] 它能够抑制酰胺转移酶,从而干扰嘌呤核苷酸合成;能够抑制次黄嘌呤核苷酸转为腺嘌呤核苷酸及次黄嘌呤核苷酸转为黄嘌呤核苷酸、鸟嘌呤核苷酸的过程;还能够抑制烟酰胺腺嘌呤二核苷酸(NAD+)的合成及引起脫氧腺苷三磷酸(dATP)和脫氧鸟苷三磷酸(dGTP)水平的下降。这使得巯嘌呤能够有效抑制DNA的合成,从而抑制肿瘤细胞的生长。[1][11]
不良反应
巯嘌呤的不良反应较多,且可能达到很严重的程度。
其中较轻的有腹泻、恶心、呕吐、食欲减退、疲倦、过敏反应(如皮疹和发痒)、脱发等;较严重的则有:骨髓抑制、发热、咽喉痛、口腔溃疡、出血、黄疸等;十分严重的(但较罕见)的有血尿、黑粪症、急性尿酸性肾病、致死性肝中毒等。[5]
骨髓抑制是巯嘌呤最常见的副作用之一;患者最好每周进行一次全血细胞计数检查,并在发现无法解释的白细胞或其他血细胞计数大幅度异常下降时停止用药。
出现骨髓抑制的病人应检查是否缺乏硫嘌呤甲基转移酶(TPMT)。TPMT在巯嘌呤和硫鸟嘌呤等巯基嘌呤类药物的代谢中有着重要的作用——患有TPMT缺乏症的人(占总人口约300分之一)在使用这些药物的时候更容易出现严重甚至致命的骨髓抑制。[12] 对这类病人来说,若有必要则仍可继续使用巯嘌呤治疗,但必须使用一个较低的剂量。
注意事项
抗痛风药别嘌醇能够抑制代谢巯嘌呤的黄嘌呤氧化酶的活性,因此同时使用两药的的患者容易导致巯嘌呤中毒。在这种情况下应该减少巯嘌呤的剂量或停用巯嘌呤。不过最近有研究显示,利用这种药物相互作用在巯嘌呤治疗时适量使用别嘌醇能够显著提高巯嘌呤对炎症性肠病无应答者(即对治疗无反应)的疗效,并且相对于增加糖皮质激素用量的方法来说更加安全。[13]
作为一种免疫抑制剂,巯嘌呤会减弱免疫系统抵抗感染的能力。接受治疗的患者在接种疫苗时必须经过主治医生批准,并且禁止注射活疫苗(如轮状病毒疫苗、脊髓灰质炎疫苗);最近注射疫苗的患者则应避免使用此药。[5]
一般来说,医生不推荐怀孕时使用巯嘌呤,因为研究证实使用巯嘌呤(或类似的硫唑嘌呤)的孕妇的胎儿异常率与流产率分别是正常人的7倍和20倍。[14] 但不同于有同样效果的甲氨蝶呤,巯嘌呤并不是一种有效的堕胎药;1999年的一项研究中所有使用它堕胎的孕妇身上在两周之后都观察到了胎儿心脏活动,因而不得不进行吸引流产。[15]
致癌性
巯嘌呤在动物和人类身上能够引起染色体变化,且有研究显示高剂量巯嘌呤与其它细胞毒药物合用会增加患上白血病的风险。[16] 不过科学家认为,对于巯嘌呤本身,尽管不能排除致癌性的可能,这种可能性总体来说是很小的;[17] 国际癌症研究机构(IARC)也仅将其列为第三类物质(尚不能确定其是否对人体致癌)。
另见
参考资料
- Sahasranaman, S.; Howard, D.; Roy, S. . European Journal of Clinical Pharmacology. 2008, 64 (8): 753–767. PMID 18506437. doi:10.1007/s00228-008-0478-6.
- Elion, G. B.; Burgi, E.; Hitchings, G. H. . Journal of the American Chemical Society. 1952, 74 (2): 411. doi:10.1021/ja01122a037.
- Clarke, D. A.; Philips, F. S.; Sternberg, S. S.; Stock, C. C.; Elion, G. B.; Hitchings, G. H. . Cancer research. 1953, 13 (8): 593–604. PMID 13082494.
- Elion, G. B.; Singer, S.; Hitchings, G. H. . Annals of the New York Academy of Sciences. 1954, 60 (2): 200–206. PMID 14350524. doi:10.1111/j.1749-6632.1954.tb40009.x.
- Thackery, Ellen. . Detroit: Thomson Gale. 2002: 685-687. ISBN 0-7876-5611-9.
- Sung, H. C.; Wu, P. C.; Ho, T. H. . Acta - Unio Internationalis Contra Cancrum. 1964, 20: 493–502. PMID 14151970.
- Shullenberger, C. C. . Cancer chemotherapy reports. Part 1. 1962, 16: 251–252. PMID 13912387.
- Baum, J.; Hurd, E.; Lewis, D.; Ferguson, J. L.; Ziff, M. . Arthritis & Rheumatism. 1973, 16 (2): 139. doi:10.1002/art.1780160202.
- Nielsen OH, Vainer B, Rask-Madsen J. . Aliment. Pharmacol. Ther. November 2001, 15 (11): 1699–708. PMID 11683683. doi:10.1046/j.1365-2036.2001.01102.x.
- Shin SJ, Collins MT. . Antimicrob. Agents Chemother. February 2008, 52 (2): 418–26. PMC 2224720. PMID 18070971. doi:10.1128/AAC.00678-07.
- Cara, C. J.; Pena, A. S.; Sans, M.; Rodrigo, L.; Guerrero-Esteo, M.; Hinojosa, J.; García-Paredes, J.; Guijarro, L. G. . Medical science monitor : international medical journal of experimental and clinical research. 2004, 10 (11): RA247–RA254. PMID 15507865.
- Yates, C. R.; Krynetski, E. Y.; Loennechen, T.; Fessing, M. Y.; Tai, H. L.; Pui, C. H.; Relling, M. V.; Evans, W. E. . Annals of internal medicine. 1997, 126 (8): 608–614. PMID 9103127.
- Sparrow, M. P.; Hande, S. A.; Friedman, S.; Cao, D.; Hanauer, S. B. . Clinical Gastroenterology and Hepatology. 2007, 5 (2): 209–214. PMID 17296529. doi:10.1016/j.cgh.2006.11.020.
- Nørgård, B.; L. Pedersen, K. Fonager, S. Rasmussen, H. Sørensen. . Alimentary pharmacology and therapeutics. March 2003, 17 (6): 827–834. PMID 12641505. doi:10.1046/j.1365-2036.2003.01537.x.
- Davis, Anne R.; Leslie Miller, Hisham Tamimi, and Allen Gown. . Obstetrics & Gynecology. June 1999, 93 (6): 904–9. PMID 10362152. doi:10.1016/S0029-7844(98)00569-9.
- Bo J, Schrøder H, Kristinsson J, Madsen B, Szumlanski C, Weinshilboum R, Andersen JB, Schmiegelow K. . Cancer. September 1999, 86 (6): 1080–6. PMID 10491537. doi:10.1002/(SICI)1097-0142(19990915)86:6<1080::AID-CNCR26>3.0.CO;2-5.
- Maekawa, A.; T. Nagaoka, H. Onodera, Y. Matsushima, A. Todate, M. Shibutani, H. Ogasawara, Y. Kodama and Y. Hayashi. . Journal of Cancer Research and Clinical Oncology. May 1990, 116 (3): 245–250. PMID 2370249. doi:10.1007/BF01612898.
- Elion, Gertrude B.; Burgi, Elizabeth; Hitchings, George H. . Journal of the American Chemical Society (American Chemical Society (ACS)). 1952, 74 (2): 411–414. ISSN 0002-7863. doi:10.1021/ja01122a037.
- Beaman, Alden G.; Robins, Roland K. . Journal of the American Chemical Society (American Chemical Society (ACS)). 1961, 83 (19): 4038–4044. ISSN 0002-7863. doi:10.1021/ja01480a021.