门冬酰胺酶
门冬酰胺酶(英語:,EC 3.5.1.1),又名天冬酰胺酶或天门冬酰胺酶,是一种催化天冬酰胺水解成天冬氨酸的酶。在自然界中,一些微生物能产生这种酶。
 | |
| 系统(IUPAC)命名名称 | |
|---|---|
E. coli L-asparagine amidohydrolase | |
| 临床数据 | |
| 商品名 | Elspar |
| Drugs.com | Monograph |
| MedlinePlus | a682046 |
| 妊娠分级 |
|
| 给药途径 | 静脉注射,肌肉注射,皮下注射 |
| 合法狀態 | |
| 合法状态 |
|
| 药代动力学数据 | |
| 生物半衰期 | 8-30 hrs |
| 识别 | |
| CAS注册号 | 9015-68-3 |
| ATC代码 | L01XX02 |
| DrugBank | DB00023 |
| ChemSpider | NA |
| UNII | G4FQ3CKY5R |
| KEGG | D02997 |
| 化学 | |
| 化学式 | C1377H2208N382O442S17 |
| 摩尔质量 | 31731.9 g/mol |
用途
不同类型的门冬酰胺酶被用于不同的用途。
门冬酰胺酶常在食品工业用作商品名为Acrylaway和PreventASe的食品加工助剂。它能够减少淀粉类食品(如饼干和薯片)中致癌物丙烯酰胺的含量。[1]
另一种商品名为Elspar的门冬酰胺酶则在临床上其他药物联合用于治疗急性淋巴细胞白血病(ALL)及某些淋巴瘤与肥大细胞瘤等癌症。[2][3][4] 不同于大部分其他化疗药物,门冬酰胺酶可通过静脉注射、肌肉注射或皮下注射给药而无须担心对周围组织的刺激与损害。
作用机理
作为食品加工助剂
在烘烤或煎炸含淀粉食物的时候(尤其是高温情况下),这类食物中天然存在的氨基酸天冬酰胺会与淀粉发生美拉德反应,而该反应使得淀粉类食物变脆且呈现出独特的色泽、气味。然而,反应同时还会产生致癌物丙烯酰胺。
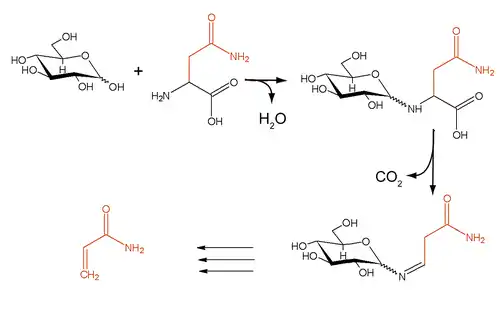
通过在烘烤或煎炸食物之前加入门冬酰胺酶,天冬酰胺被水解成为天冬氨酸和氨。这使得天冬酰胺无法继续参与美拉德反应,从而显著减少食品加工时产生的丙烯酰胺量。门冬酰胺酶能够最多将各种淀粉类食品中的丙烯酰胺含量减少90%,同时不影响产品的味道与外观。[5] 不过由于其他无天冬酰胺参与的反应也能产生少量的丙烯酰胺,目前生产上仍未能够做到完全杜绝这种致癌物的产生。[1]
药物副作用
门冬酰胺酶的主要不良反应是过敏或超敏反应,表现为发热、寒战、血压下降、皮疹,甚至有可能出现全身过敏反应以致休克。[2] 除此之外,它还能够抑制某些蛋白质的合成,如凝血因子(一般为纤维蛋白原)和抗凝血因子(一般为抗凝血酶,有时还包括蛋白质C和蛋白质S),从而引起出血或中风。[7] 骨髓抑制亦十分常见,但通常较轻,极少达到需要为此而改变治疗方案的程度。[8]
药物发现历史
门冬酰胺酶的抗癌效应最早是在1953年被发现的——科学家观察到大鼠和小鼠的淋巴瘤在用豚鼠的血清治疗后发生了退化。[9] 之后研究者发现使肿瘤退化的不是血清本身,而是其中的门冬酰胺酶。[10] 随后在1966年和1967年对其进行了一系列的临床试验,并逐渐将其投入治疗急性淋巴细胞白血病。[7]
在比较不同类型的门冬酰胺酶后,人们发现由大肠杆菌(Escherichia coli)和菊欧文氏菌(Erwinia chrysanthemi)产生的酶具有最好的抗癌能力。大肠杆菌产生的酶(即Elspar)因为除了效果好还容易做到大量生产,所以成为了目前门冬酰胺酶的主要来源。[7] 菊欧文氏菌产生的酶则采用另一个商品名Crisantaspase,或是在英国销售时的商品名Erwinase。[2]
参考资料
- Kornbrust, B.A., Stringer, M.A., Lange, N.K. and Hendriksen, H.V. (2010) Asparaginase – an enzyme for acrylamide reduction in food products. In: Enzymes in Food Technology, 2nd Edition. (eds Robert J. Whitehurst and Maarten Van Oort). Wiley-Blackwell, UK, pp. 59-87.
- . . United Kingdom: BMJ Group and RPS Publishing. March 2009: 476. ISBN 978-0-85369-845-6.
- 孙燕. . 北京: 北京大学医学出版社. 2006. ISBN 978-7-811-16205-9.
- Appel IM, van Kessel-Bakvis C, Stigter R, Pieters R. . Leukemia. 2007, 21 (11): 2377–80. PMID 17554375. doi:10.1038/sj.leu.2404793.
- Hendriksen, H.V.; Kornbrust, B.A.; Oestergaard, P.R.; Stringer, M.A. . Journal of Agricultural and Food Chemistry. 2009-04-23, 57 (10): 4168–4176. PMID 19388639. doi:10.1021/jf900174q.
- Broome, J. D. . Cancer treatment reports. 1981,. 65 Suppl 4: 111–114. PMID 7049374.
- Müller, H. . Critical Reviews in Oncology/Hematology. 1998, 28 (2): 97–11. doi:10.1016/S1040-8428(98)00015-8.
- Johnston, P. G.; Hardisty, R. M.; Kay, H. E.; Smith, P. G. . British medical journal. 1974, 3 (5923): 81–83. PMC 1611087. PMID 4604804.
- Kidd, J. G. . The Journal of experimental medicine. 1953, 98 (6): 565–582. PMC 2136344. PMID 13109110.
- Broome, J. D. . The Journal of experimental medicine. 1963, 118 (1): 99–120. PMC 2137570. PMID 14015821.
外部链接(英文)
- MeSH(醫學主題詞)上面的Asparaginase(美式英语)
- Macmillan Cancer Support上面的药物信息:Crisantaspase information
- 美国国家卫生研究院的药物信息
