吲哚
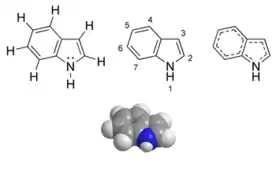
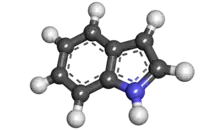
吲哚(拼音:,注音:,粤拼:,音同「引朵」、IUPAC命名:indole),是芳香杂环有机化合物,為双环结构,包含了一个六元苯环和一个五元含氮的吡咯环。因为氮的孤对电子参与形成芳香环,所以吲哚不是碱,性质也不同于简单的胺。
| 吲哚 | |
|---|---|
 | |
 | |
| IUPAC名 Indole | |
| 别名 | 2,3-苯并吡咯 |
| 识别 | |
| CAS号 | 120-72-9 |
| PubChem | 798 |
| ChemSpider | 776 |
| SMILES |
|
| InChI |
|
| InChIKey | SIKJAQJRHWYJAI-UHFFFAOYAI |
| ChEBI | 16881 |
| RTECS | NL2450000 |
| KEGG | C00463 |
| 性质 | |
| 化学式 | C8H7N |
| 摩尔质量 | 117.15 g·mol⁻¹ |
| 外观 | 白色固体 |
| 密度 | 1.22 g/cm3,固体 |
| 熔点 | 52 - 54℃ (326 K) |
| 沸点 | 253 - 254℃ (526 K) |
| 溶解性(水) | 0.19 g/100 ml (20 ℃) 溶于热水 |
| pKa | 16.2 (在DMSO中为21.0) |
| pKb | 17.6 |
| 结构 | |
| 晶体结构 | ? |
| 分子构型 | 平面 |
| 偶极矩 | 2.11 D(在苯中) |
| 危险性 | |
| 警示术语 | R:R21/22-R37/38-R41-R50/53 |
| 安全术语 | S:S26-S36/37/39-S60-S61 |
| MSDS | |
| 闪点 | 121℃ |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
在室温,吲哚是固体。吲哚广泛分布于自然环境中,尤其是人类和畜禽粪便之中,并且有强烈的粪臭味。然而,在很低的浓度下,吲哚具有类似于花的香味[1],是许多花香的组成部分 ,例如橘子花,吲哚也用来制造香水,煤焦油也會有吲哚。
在很多有机化合物中能发现吲哚结构,比如色氨酸及含色氨酸的蛋白质,生物碱及色素中也包含有吲哚结构。
吲哚能发生亲电取代反应,多取代于3号位。取代吲哚是许多色胺碱的基础结构,比如神经传递素复合胺,褪黑素,迷幻药,二甲基色胺,5-甲氧基-二甲基色胺和LSD。其他的吲哚化合物包括植物生长素(吲哚-3-乙酸),抗炎药物消炎痛(茚甲新)和血管舒张药物心得乐。
吲哚的名称indole是由indigo(靛藍)和oleum(发烟硫酸)所组成,因为吲哚首次制得是通过混合靛蓝和发烟硫酸。
历史
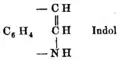
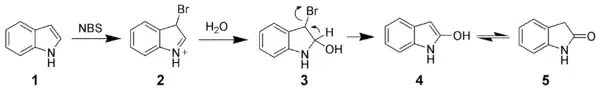
吲哚化学是随着对靛青的研究开始发展的,继而转化为研究靛红,然后是羟吲哚。在1866年,阿道夫·冯·拜尔用锌粉将羟吲哚还原为了吲哚[2]。1869年,他假设出了吲哚的结构,至今仍然被大家公认[3]。
直到19世纪末,某些吲哚化合物也仅仅是作为重要的染料来看待。到了20世纪30年代,人们对吲哚的兴趣逐渐增强,因为吲哚作为一个核心基团出现在了很多重要的生物碱中,例如色氨酸和植物激素,到现在对于吲哚的研究仍然很活跃[4]。
吲哚的化学反应
亲电取代反应
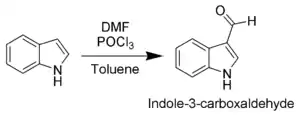
吲哚上最容易发生亲电取代反应的位置是3位,它的活性是其苯环碳的1013倍。例如Vilsmeier-Haack酰化反应在室温下就能于3位碳上发生[9]。由于吡咯环上电子富集,往往在1位氮和2,3位碳都被取代后,苯环上的亲电取代反应才可能发生。
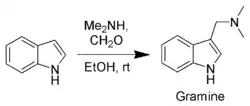
芦竹碱是一种由吲哚、二甲胺和甲醛通过Mannich反应得到的常用中间体。它是3-吲哚乙酸和色氨酸的前体。
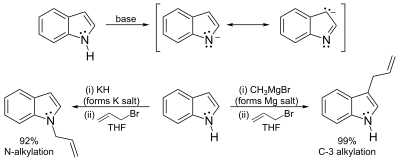
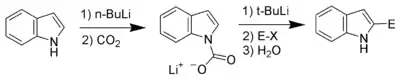
N位氢的酸性和金属有机盐
N位氢在DMSO中电离的pKa是21,所以需要非常强的碱,诸如氢化钠或者丁基锂,才有可能在无水环境下将之去质子化。得到的金属有机盐(具有非常强的碱性)有两种存在形式。对于难成共价键的钾、钠离子,负电荷集中在1位氮上;而对于可以成共价键的镁(包括Grignard试剂)和(尤其是)锌,负电荷则集中在3位碳上。类似的,在极性非质子溶剂比如DMF或DMSO中,1位氮易受到亲电试剂进攻;而在非极性溶剂比如甲苯中,则是3位碳更活泼[10]。
碳上氢的酸性和2位碳的锂化
2位碳上的氢酸性排第二。对于氮被保护了的吲哚衍生物,丁基锂或二异丙基氨基钾就专一地在2位碳上发生去质子反应,得到非常强的亲核试剂。 Bergman 和 Venemalm 开发出了在不保护氮的条件下在2位碳上取代的反应[11]。
Alan Katrizky 也曾开发出过类似的技术[12]。
参见
引用
- http://www.leffingwell.com/olfact5.htm
- Baeyer, A. . Ann. 1866, 140 (3): 295. doi:10.1002/jlac.18661400306.
- Baeyer, A.; Emmerling, A. . Chemische Berichte. 1869, 2: 679. doi:10.1002/cber.186900201268.
- R. B. Van Order, H. G. Lindwall. . Chem. Rev. 1942, 30: 69–96. doi:10.1021/cr60095a004.
- Gribble G. W. . J. Chem. Soc. Perkin Trans. 1. 2000, (7): 1045. doi:10.1039/a909834h.
- Cacchi, S.; Fabrizi, G. . Chem. Rev. 2005, 105 (7): 2873. PMID 16011327. doi:10.1021/cr040639b.
- Humphrey, G. R.; Kuethe, J. T. . Chem. Rev. 2006, 106 (7): 2875. PMID 16836303. doi:10.1021/cr0505270.
- Gerd Collin and Hartmut Höke “Indole” Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a14_167.
- James, P. N.; Snyder, H. R. . Organic Syntheses. 1959, 39: 30 [2011-06-27]. (原始内容存档于2012-10-02).
- Heaney, H.; Ley, S. V. . Organic Syntheses. 1974, 54: 58 [2011-06-27]. (原始内容存档于2012-10-02).
- Bergman, J.; Venemalm, L. . J. Org. Chem. 1992, 57 (8): 2495. doi:10.1021/jo00034a058.
- Alan R. Katritzky, Jianqing Li, Christian V. Stevens. . J. Org. Chem. 1995, 60 (11): 3401–3404 [2011-06-27]. doi:10.1021/jo00116a026. (原始内容存档于2020-03-16).
- Lynch, S. M. ; Bur, S. K.; Padwa, A. . Org. Lett. 2002, 4 (26): 4643. PMID 12489950. doi:10.1021/ol027024q.
外部链接
| 维基共享资源中相关的多媒体资源:吲哚 |
- Synthesis of indoles (overview of recent methods) 页面存档备份,存于
- Synthesis and propierties of indoles 页面存档备份,存于 at chemsynthesis.com
.svg.png.webp)