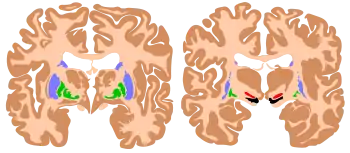
脑
脑(英語:Brain)作为一个器官,是所有脊椎动物和大部分无脊椎动物都具有的神经系统中心。它位于头部,通常靠近感觉器官,如视觉器官。脑是脊椎动物身体中最复杂的器官。人类的大脑皮质包含大约140-160亿神经元,[1] 小脑中包含大约550-700亿神经元。[2]每一个神经元都通过突触和其他数千个神经元相连接。这些神经元之间通过称作轴突的原生质纤维进行较长距离互相联结,可以将一种称作动作电位的冲动信号,在脑的不同区域之间或者向身体的特定接收细胞传递。
| 大腦 | |
|---|---|
 黑猩猩的脑 | |
| 识别标示 | |
| MeSH | D001921 |
| NeuroNames | 21 |
| TA98 | A14.1.03.001 |
| TA2 | 5415 |
| 解剖學術語 | |
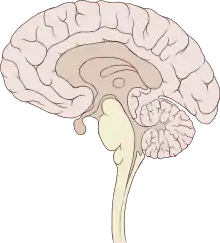

从生理上来说,脑的功能就是控制身体的其他器官。脑对其他器官的作用方式,一是调制肌肉的运动模式,二是通过分泌一些称为荷尔蒙的化学物质。集中的控制方式,可以对环境的变化做出迅速而一致的反应。 一些基本的反应,例如反射,可以通过脊髓或者周边神经节来控制,然而基于多种感官输入,有心智、有目的的动作,只有通过脑中枢的整合能力才能控制。
关于单个脑细胞的运作机制,现今已经有了比较详细的了解;然而数以兆亿的神经元如何以集群的方式合作,还是一个未解决的问题。[3]现代神经科学中,新近的模型将脑看作一种生物计算机,虽然运行的机制和电子计算机很不一样,但是它们从周围世界中获得信息、存储信息、以多种方式处理信息的功能是类似的,它有点像计算机中的中央处理器(CPU)。
本文会对各种动物的脑进行比较,特别是脊椎动物的脑,而人脑将被作为各种脑的其中一种进行讨论。人脑的特别之处会在人脑条目中探讨,因为其中很多话题在人脑的前提下讨论,内容会丰富得多。其中最重要的,是脑疾病与脑损伤造成的后果,它会被放在人脑条目中探讨,因为人脑的大多数常见疾病并不见于其他物种,即使有,它们的表现形式也可能不同。
解剖学
对于不同的物种来说,脑的形状和尺寸差别很大,要在其中找出共同的特征很困难。[4]然而在很多物种的脑结构之间存在许多共同的规律。[5]脑的各种结构特征中,有一部分在几乎所有动物之间都是共通的;[6]而另外一些会出现在较“先进”的脑中,或者仅出现在脊椎动物中而不出现于无脊椎动物中。[4]
要了解脑的解剖结构,最简单的办法就是从视觉外观着手,但是人们也发展出了更先进的技术。自然状态下的脑组织很软,很难处理,但是在酒精或者其他固化剂中浸泡之后脑组织会硬化,从而很容易切开研究其内部结构。从外观上,脑的内部分为颜色较暗的灰质和颜色较浅的白质。如果用不同的化学物质对脑组织染色,还可以显示出不同类型的分子聚集在不同的地方。还可以使用显微镜研究脑组织,追踪贯穿各个脑区域的神经联结。[7]
细胞构架
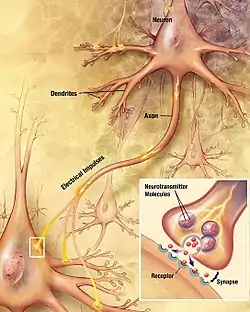
所有动物的脑都是主要由两类细胞组成:神经元和神经胶质细胞。神经胶质细胞(Glial cells、glia,或稱neuroglia) 分为许多种类型,承担各种重要作用,包括结构性支撑、维持新陈代谢、作为绝缘体、以及引导神经生长。神经元常常被看作脑中最重要的细胞。[8]神经元可以将信号远程传递到特定的细胞,这是它们和其他细胞最大的区别。[8]它们通过轴突来传递信号,轴突是一种原生质构成的纤维,通常会有许多分叉。它们从神经细胞体长出,投射到其他区域:可能是邻近的区域,也可能是脑或者身体的较远部位。轴突的长度差异极大。例如锥体细胞(脑皮质的一种兴奋性神经元),如果将它的细胞体放大到一个人的大小,那么它的轴突同比例放大之后会有几厘米粗,超过1公里长。[9]这些轴突通过一种称为动作电位的电脉冲信号来传递信息,持续时间短于千分之一秒,在轴突中传播速度大约1-100米/秒。有一些神经元稳定地发放动作电位,每秒大约10-100次,另一些神经元在大部分时候处于静息状态,但是会偶然地发放动作电位。[10]
轴突通过一种称为突触的特化节点来向其他神经元传递信号。一个轴突可以和多达数千个其他神经细胞形成突触联结。[8]当一个动作电位通过轴突传递到一个突触时,它会触发释放一种称为神经递质的化学物质。神经递质会和突触后细胞膜上的受体相结合。[8]
突触是脑的关键功能组成部分。[11]脑的核心功能是细胞之间的联结,而突触就是产生联结的地方。人类的脑估计有1,000,000,000,000,000(1015)个突触联结;[12]而即使是果蝇的脑也包含几百万个突触。[13]这些突触的功能各不相同:有的是兴奋性的(可以使突触后细胞兴奋),有的是抑制性的,还有的通过激活第二信使系统来通过复杂的机制改变突触后细胞的化学性质。[11]许多突触都是动力学可变的,意即它们可以根据通过它们的信号形式而改变其强度。人们普遍相信,突触可塑性是脑进行学习和记忆的首要机制。[11]
脑中的大部分空间被轴突所占据,它们常常会汇集成所谓的“神经纤维束”。一些轴突被称为髓鞘的脂质鞘状物包裹,称为髓鞘化轴突,它们的神经传导速度会大大提高。然而也存在无髓鞘轴突。髓鞘是白色的,所以脑中布满神经纤维的部分颜色较浅,被称作白质;与之相反,在神经细胞体高度聚集的区域颜色较深,被称作灰质。[8]
普通两侧对称神经系统

除了少数原始的动物例如海绵(它没有神经系统[14])和水母(有离散的神经网络[14]),所有的现生多细胞动物都是两侧对称动物,意味着它们的身体形状是左右对称的。[15]人们相信,所有的两侧对称动物都具有共同的祖先,出现与4.85-5.40億年之前的寒武纪;根据假设,它的形状像是简单的管虫,身体分节。[15]可以大致认为,这种蠕虫的基本形态在所有现代两侧对称动物的体型和神经系统中都有反映,包括脊椎动物。[16]两侧对称动物的基本形态是中空的管状,有一个管道从口通到肛门;还有神经索,在每一个体节处会有膨大(称为神经节),在前端会有特别膨大的神经节,称为脑。一些物种的脑小且简单,例如线虫动物;而对于包括脊椎动物在内的其他动物,它是身体最复杂的器官。[4]而另一些蠕虫例如水蛭,在神经索的尾端也有膨大的神经节,称作尾脑(tail brain)。[17]
有少数现存的两侧对称动物没有能够辨认的脑,包括棘皮动物、尾索动物和无腔动物门(一种原始的扁虫)。这些没有脑的物种的存在,究竟是说明了最早的两侧对称动物是没有脑的,还是它们的祖先在演化中丢失了脑结构,现在尚无定论。[18]
无脊椎动物
.jpg.webp)
无脊椎动物包括节肢动物、软体动物和许多种蠕虫。无脊椎动物脑的多样性程度,和它们身体的多样性同一等级。[19]
两类无脊椎动物有相当复杂的脑:节肢动物(包括昆虫、甲壳亚门、蛛形纲等等)以及头足纲(章鱼、鱿鱼和类似的软体动物)。[20]节肢动物和头足纲的脑从贯穿身体的两条平行神经索中产生。节肢动物有一个分为三部分的脑中枢,每只眼睛后面用于处理视觉信息的视叶很大。[20] 无脊椎动物中脑最大的是头足类动物(如章鱼和鱿鱼)。[21]
有一些无脊椎动物因为易于进行实验,它们的脑已经得到了深入研究:
- 果蝇(Drosophila),对它的研究发展了丰富的遗传学技术,使它成为了适合研究基因对脑发育影响的天然样本。[22] 尽管昆虫和人类有着巨大的演化差异,果蝇的许多神经遗传学特性被证实和人类相关。例如,第一个识别出的生物钟就是来自昼夜节律被扰乱的突变果蝇。[23]对于脊椎动物的基因组的研究发现了类似的一组基因,它在小鼠身上也起着类似的生物钟作用——几乎也可以肯定,人类的生物钟也是如此。[24]对于果蝇的研究也揭示了,脑的神经纤维网区域会终身不断地重组,作为对生活环境的回应。[25]
- 可独立生活的线虫秀丽隐杆线虫(Caenorhabditis elegans)和果蝇一样,都因为遗传学上的重要性被深入研究。[26]在1970年代早期,西德尼·布伦纳将其选为研究基因控制发育的模式生物。使用这种生物做实验的好处是,它的结构非常的单一:雌雄同体,每一条虫都包含精确的302个神经元,且在同一位置进行突触联结。[27]布伦纳的团队将该线虫切成上千个薄片,将每一片放在电子显微镜下照相,然后通过人眼将每一片上的神经纤维组合,从而绘制出整个身体的每一个神经元和突触。[28]如此他们绘制了秀丽隐杆线虫完整的神经“连线图”——称为联结图谱。[29]对于任何其他的生物都没有过这种程度的详细研究,从中得到的信息促生了许多研究成果。[30]
脊椎动物

最早的脊椎动物出现在5亿年前的寒武纪,形状类似于今天的盲鳗。[32]鲨鱼大约出现于4.5亿年前,两栖动物出现在4亿年前,爬行动物出现于3.5亿年前,而哺乳动物出现在大约2亿年前。每一个物种的演化时间都是同样的,然而现代的盲鳗、七鳃鳗、鲨鱼、两栖动物、爬行动物和哺乳动物的脑尺寸和复杂度呈现出逐渐上升的趋势,和演化序列相吻合。它们的脑都包含了同样的基本解剖结构,然而脑的最前端(大脑)在盲鳗那里还是很原始的,在哺乳动物身上就变得巨大和精致了。[33]
很多情况下,我们会简单地比较脑的大小。对于许多脊椎动物,它们的脑容量、身体大小和其它变量之间的关系已经得到了研究。脑容量会随着身体大小增加,但并不是简单线性的。大致来说,较小的动物的脑会占有身体中的较大比例。对于哺乳动物来说,脑容量和体重的关系服从幂定律,其幂指数约为0.75。 [34]这个公式描述了集中趋势,但是哺乳动物的每一个科都会或多或少地偏离它,部分地反映了它们行为的复杂程度。例如,灵长类的脑大约比该公式的结果大5-10倍。捕猎者一般比它们的猎物拥有更大的脑/身体比例。[35]
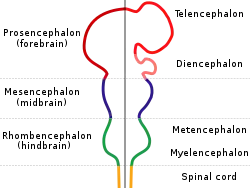
所有脊椎动物的脑共用同样的底层结构,在胚胎发育的早期很清楚地表现出来。在胚胎的最早阶段,脑呈现为神经管上的三处膨大,它们会分别发育成前脑、中脑和菱脑(后脑)。在脑发育的最初阶段,这三个部分的大小大致相同。对于许多脊椎动物,例如鱼类和两栖动物,成年之后这三个部分大小仍然差不多,然而哺乳动物的前脑会比其它部分大很多,中脑则会变得很小。[8]
脊椎动物的脑由非常柔软的组织构成。[8]活的脑组织的外表呈粉红色,而内部大多为白色,包含一些细微的颜色变化。脊椎动物的脑由一种称为脑脊膜的结缔组织生物膜系统包裹着,间隔在颅骨和脑之间。血管通过脑脊膜上的孔进入中枢神经系统。血管壁的细胞排列很紧密,形成了血脑屏障,阻止了许多毒素和病原体,[36]然而也会阻止抗体和一些药物,给脑疾病的治疗带来了许多挑战。[37]
神经解剖学家们通常把脊椎动物的脑分为6个主要部分:端脑(大脑半球)、间脑(丘脑和下丘脑)、中脑、小脑、桥脑和延髓。每一个部分又可细分出很多结构。其中一些部分,例如大脑皮质和小脑皮质,包含一些摺叠与卷曲以减小占用的空间。其他一些部分,例如丘脑和下丘脑,包含许多小型的核团。通过神经结构、化学和联结上的区分,可以在脊椎动物的脑中辨认出上千个结构部分。[8]
虽然所有的脊椎动物脑都包含同样的基本组成部分,但是其中一些演化分支的脑的外观发生了巨大的变形,特别是在前脑区域。鲨鱼的脑的基本部分都是正向的,但是真骨附类的鱼类(包含一大类已经灭绝的鱼)的前脑是“翻转过来”的,就像一只袜子内外翻转了一样。鸟类的前脑结构也发生了重要变异,[38]其变形程度之大导致很难将一个物种的脑结构和另一个物种的相匹配。[39]

以下列出了脊椎动物脑的一些最重要的部分,以及有关它们已知功能的简述:
- 延髓(Medulla oblongata),和脊髓相连接,包含许多小的核团,负责多种感觉和非自主运动功能,例如心跳、消化、呕吐。[8]
- 桥脑(Pon)属于脑干的一部分,位于延髓之上。它包含的核团负责控制一些通常是自主的,但是很简单的行为,例如睡眠、呼吸、吞咽、膀胱功能、平衡、眼动、表情和姿态。[40]
- 下丘脑(Hypothalamus)是前脑中一个相对于其复杂性和重要性来说,尺寸比较小的区域。它包含许多小的核团,每一个核团都有单独的联结和神经化学性质。下丘脑负责协助一些非自主或者部分自主的活动,例如睡眠-清醒周期、饮食行为,并且释放一些荷尔蒙。[41]
- 丘脑(Thalamus)包含许多功能分散的核团:有一些负责从大脑半球中转和交换信息,另一些和运动有关。丘脑后方的区域(未定区)可能是包含一些运动调节系统以作用于一些“完成行为”(consummatory behaviors),类似吃、喝、排便和性交。[42]
- 小脑(Cerebellum)负责调制其他脑区的输出。不管是和运动相关的输出还是和思维相关的输出,都可以使它们变得更加确定与精确。去掉小脑不会妨碍动物任何特定的动作,但是会使得动作变得犹豫和笨拙。小脑的精确性能力不是与生俱来的,而是在反复试验和犯错中习得的。在骑自行车过程中习得的肌肉协调性,是主要发生在小脑中的神经可塑性的一个例子。[8]人脑10%的体积和50%的神经元数目都包含在小脑中。[43]
- 视顶盖(Optic tectum)可以让动作指向空间的某个点,通常是对视觉输入的回应。对于哺乳动物来说,它相当于是上丘,是中脑的一部分。在它的功能中,指引眼动的功能得到了最好的研究。它也负责指导“伸向”的动作和其他指向对象的动作。它接受强烈的视觉输入,但同样也接收其他对于判定方向有帮助的感觉输入,例如猫头鹰的听觉、蛇的热红外感觉。在一些原始的鱼类,例如七鳃鳗,这个区域是脑中最大的区域。[44]
- 脑皮质(Pallium)是位于前脑表面的一层灰质,它是脑器官最复杂和最新近的演化发展。[45]在爬行动物和哺乳动物的脑中,它称为大脑皮质。许多功能和皮质相关,包括嗅觉和空间记忆。哺乳动物的大脑皮层大到足以成为脑的主导,可以压制许多其他脑区的功能。许多哺乳动物的脑皮层包括隆起的皱褶,称为脑回(gyri),其间是凹进去的沟,称作脑沟(sulci)。沟回皱褶增加了皮层的面积,使得灰质的总量增加,可以储存和处理更多的信息。[46]
- 海马体(Hippocampus),严格来说只在哺乳动物中出现,虽然它所起源的内侧皮层在所有脊椎动物都可以找到对应。有证据表明,海马体和一些复杂的活动有关,例如空间记忆和导航。[47]
- 基底核(Basal ganglia)是前脑中一组互相联结的结构。基底核的首要功能可能是行为选择:它们将抑制信号发送到脑中可以引起动作行为的部位,而遇到恰当的情形可以解除抑制,于是动作发生系统可以发起动作。而奖惩作用中最主要的神经过程,就是发生在基底核的神经联结变化上。[48]
- 嗅球(Olfactory bulb)是一个特殊的结构,它负责处理嗅觉信息,然后将其输出传递到皮层中负责嗅觉的区域。对于许多脊椎动物来说它是脑的最主要部分,但是在人类和其他灵长类中大幅缩小了(他们的感觉主要来自视觉而非嗅觉)。[49]
哺乳动物
哺乳动物和其他脊椎动物的脑最明显的区别是其尺寸。平均来说,在身体大小相同的情况下,哺乳动物的脑是鸟类的2倍,是爬行动物的10倍。[50]
然而尺寸还不是唯一的区别:在形状上有更基本的不同。哺乳动物的菱脑和中脑与其他脊椎动物并无太大区别,然而前脑发生了巨大的改变,尺寸剧增,结构也发生了变化。[51] 大脑皮质的存在是哺乳动物和其他脊椎动物脑之间最大的区别。其他脊椎动物的大脑表面由称作皮层(Pallium)的简单三层结构。而哺乳动物的皮层演化成了复杂的六层结构称为新皮质(neocortex或者isocortex)。[52] 哺乳动物许多位于新皮质边缘的区域,包括海马体和杏仁核也得到了进一步的巨大发展。[51]
大脑皮质的完善发育给其他脑区也带来了变化。例如对于大多数脊椎动物来说在视觉控制方面非常重要的上丘,在哺乳动物那里缩小了很多,其大部分功能都被大脑皮质的视觉区域取代了。[50] 哺乳动物的小脑包括一大片区域用于支持大脑皮质,称为新小脑(neocerebellum),其他脊椎动物则没有相应的部分。[53]
灵长类
| 物种 | EQ[54] |
|---|---|
| 人类 | 7.4–7.8 |
| 黑猩猩 | 2.2–2.5 |
| 普通猕猴 | 2.1 |
| 宽吻海豚 | 4.14[55] |
| 象 | 1.13–2.36[56] |
| 狗 | 1.2 |
| 貓 | 1.0 |
| 马 | 0.9 |
| 大鼠 | 0.4 |
人类和其他灵长类的脑的结构和其他哺乳动物一样,但是占身体的比例总的来说更大。[57][58]人類的大腦估計已經包含50-100億個(1011)神經元,其中約10億個(1010)是皮質錐體細胞。這些細胞信號傳遞到對方通過多達1,000,000,000,000,000(1015)突觸連接。[59]脑化指数(EQ)是最广为接受的跨物种衡量脑尺寸的方式,考虑了脑与身体的非线性关系。[54]人类的EQ值在7-8之间,而大部分灵长类是2-3。海豚的EQ值高于除了人类之外的灵长类,[55]但是几乎所有的其他哺乳动物的EQ值都要低得多。
灵长类脑的增大主要归功于大脑皮质的大幅度增加,特别是前额叶皮质以及和视觉相关的皮质区域。[60]灵长类的视觉处理网络包含至少30个可以识别的区域,互相以复杂的网络相联结。据估计,视觉处理区域占据了灵长类新皮质至少一半的表面积。[61]前额叶皮质负责包括规划、工作记忆、动机、注意以及管控功能等,它所占比例在灵长类中比其他动物要大,而人类的脑中它占有特别大的比例。[62]
生理
脑的功能基于神经元将电化学信号传递给其它细胞的能力,以及神经元正确回应来自其它细胞的电化学信号的能力。神经元的膜电位受到许多生物化学和代谢过程的控制,特别是在突触发生的神经递质和受体的作用。[8]
神经递质和受体
神经递质是一种化学物质,当动作电位到达突触时,突触就会释放神经递质——突触后细胞膜上的受体分子和神经递质结合后,会改变受体分子的化学或者电性质。除了少数例外,脑中的每一个神经元在它和其它神经元形成的突触上,只会释放一种神经递质,或者神经递质的组合。这个规则被称作戴尔规则。[8]因此,神经元可以按照它所释放的递质来进行归类。许多精神药物的功能就是改变某种特定的神经递质系统的作用,包括大麻素、尼古丁、海洛因、可卡因、酒精、氟西汀和氯丙嗪等等。[63]
脊椎动物脑中最常见的两种神经递质是通常为兴奋性的谷氨酸和抑制性的GABA。几乎在脑中所有部分都有神经元使用这两种神经递质。[64]因为它们存在的普遍性,作用于谷氨酸和GABA的药物会产生广泛而强烈的效果。一些全身麻醉是通过减少谷氨酸起作用;大多数镇静剂的效果来源于促进GABA的作用。[65]
除谷氨酸及GABA之外,还有几十种其他化学神经递质在脑的其他更局部的区域内使用,通常是执行某一种特别功能的区域。 例如血清素,仅仅出现于称为中缝核的脑干区域,它是抗抑郁药物和许多减肥疗法的首要目標。[66]和醒覺作用有关的去甲肾上腺素只在一个称为蓝斑核的小区域内才出现。[67]其他的神经递质,例如乙酰胆碱和多巴胺在脑中有很多来源,但是并未像谷氨酸和GABA那样广泛分布。[68]
电活动
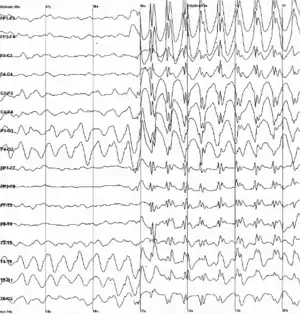
作为神经信号的电化学过程的副作用,脑组织会在活动时产生电场。当大批神经元同步活动时,它们所产生的电场可以被脑电图(EEG)[69]或者脑磁图(MEG)记录下来。EEG的记录以及动物(例如大鼠)实验中植入脑部的电极显示,活的动物的脑持续处于激活状态,包括睡眠中。[70]脑的各部分表现出节律性和非节律性的混合,会随着行为状态而改变。对于哺乳动物来说,大脑皮层在睡眠时会呈现波幅大而缓慢的Delta波,在清醒但是静息时会展示较快的Alpha波,而在活跃执行任务时脑电活动呈现混沌无规律。在癫痫发作时,脑的抑制机制失控,电活动会病理性上升,脑电图会显示健康人的脑中不会出现的大幅度波动和尖峰。将这些群体性的放电图样和单个的神经活动联系起来,是如今神经生理学的一个重要研究方向。[70]
代谢
所有的脊椎动物都有血脑屏障,使得脑内的新陈代谢和身体其他部分的不同。神经胶质细胞在脑的新陈代谢中起着重要作用,它控制神经元周围液体的化学成分,包括离子和营养物质的浓度。[71]
比起它的体积来,脑组织要消耗非常大量的能量,向动物提出了更高的代谢需求。一些物种基于减轻体重的演化选择需求(例如蝙蝠为了飞行),选择了减小脑容量。[72]脑所消耗的大部分能量用于保持神经元的电活性(膜电位)。[71]大部分的脊椎动物的基础代谢的2%-8%用于脑,对于灵长类来说,这个百分比要高得多,而人类高达20%-25%。[73]脑的能量消耗并不会随时间大幅度变化,但是大脑皮质中的活跃区域会比不活跃区域消耗更多的能量。基于这个原理,产生了PET、fMRI、[74]近红外光谱技术这样的脑成像技术。[75]脑通常通过葡萄糖(血糖)等的有氧代谢获得其大部分能量,[71]把酮体作为备用能源,除此之外还有一些中链脂肪酸(辛酸[76]和庚酸)、[77]乳酸、[78]乙酸盐,[79]也许还有氨基酸。[80]
功能
从演化生物学的视角来看,脑的功能是为动物的行为提供协调的控制。一个集中化的脑可以使得肌肉组以复杂的方式协调运动,使得身体的一端受到的刺激可以引发另一端的反应,还可以防止身体的不同部分动作互相牴觸。[81]
为了产生有目的的和统一的动作,脑首先将来自感觉的信息统一传送到中央系统,然后整合这些数据以得到有关环境结构的信息。之后,它将感官信息和动物目前的需求以及过去状况的记忆结合在一起。最后,它基于这些结果产生动作回应,以使得动物获得最大回馈为目标。这一系列信息处理任务需要许多功能子系统的复杂合作。[81]
信息处理
电子计算机于1940年代发明,同时出现的还有数学化的信息论,使得脑有可能作为信息处理系统来理解。这个观念构成了控制论的基础,也进一步促生了我们现今称为计算神经科学的领域。[82]控制论的最早尝试显得有些粗糙,当时将脑的本质看作一台隐藏起来的计算机。例如约翰·冯·诺伊曼1958年的著作《计算机与人脑》。[83]经过了多年有关动物行为和脑细胞电活动的数据积累,这个领域已经由理论概念变得越来越实在。[82]

信息处理过程研究的实质,是试图用信息流与算法的执行来理解脑的功能。[82]其中最具影响力的早期工作,是1959年的论文《青蛙的眼睛告诉了青蛙的脑什么》(What the frog's eye tells the frog's brain),这篇论文研究了青蛙视网膜和上丘(视顶盖)中的神经元的视觉回馈,得出结论,青蛙顶盖中的一些神经元联结会产生一些初级的功能,研究者们将其称作“虫子感知”。[84]几年后,大卫·休伯尔和托斯坦·威泽尔在猴的初级视皮层中发现了一些细胞,如果有明显的边缘从视野的某个点移动过去的时候它就会被激活。他们因为这个发现获得了诺贝尔奖。[85]随后的研究在更高级的视觉区域发现了探测双眼视差、色彩、运动和形状的细胞,它们距离初级视皮层越远,其反应内容就越是复杂。[86]其他关于和视觉无关的脑区域的研究,揭示了脑细胞的活动和多种多样的功能相关,一些和记忆相关,另一些和空间等抽象认知相关,等等。[87]
理论研究者们通过建立数学化的神经系统网络模型进行计算机模拟来理解神经系统的反应方式。[82]许多有用的模型是抽象的,着眼于神经系统算法的概念结构,而非它们在脑中结构的细节;而另一些模型试图将真实神经细胞的生理物理学性质包含进去。[88]然而现今不论在任何层面上,都没有一个模型能够完整地描述脑的功能。其中本质的困难在于,神经网络的完善计算包括成千上万神经元的协同工作,而目前的技术只能同时记录少数神经元的动作电位。[89]
除此以外,每一个神经元都表现得很复杂,可以进行计算任务。[90]所以没有反映这一点的脑模型可能被认为过于抽象,无法代表脑的运作;而考虑到这一点的的模型会消耗大量的计算资源,以现有的计算能力无法实现。尽管如此,人脑工程还是试图建立一个真实而详尽的整个人脑的计算模型。现在人们还在等待它在预定时间内可以完成何种程度的成果,关于它是否有效也正在进行公开争论,争论双方都有重要的科学家。
感觉

脑的首要功能之一,就是从感官的输入中提取出生物所需要的信息。人脑会接收到光、声音、空气中的化学成分、温度、热源、身体位置、血液中的化学成分等等信息。其他生物可能还有其他感官,例如蛇的热红外感觉、一些鸟的磁感觉或者一些鱼类对电场的感觉。此外,还有一些动物可能会改造已经存在的感觉系统,例如蝙蝠将听力系统改造为声波雷达。所有这些感觉方式通过特定的一种或者几种传感器将信息传递到大脑。[8]
每一种感觉系统都是从特化的感受器细胞开始,例如眼睛视网膜中的感光细胞,耳朵的耳蜗中的振动感觉细胞,或者皮肤上的压力感受神经元。感受器细胞的轴突会进入脊髓或脑,感觉系统的信号会被转换为刺激模式。初级感觉核团将信息传递到同一模式的更高级的感觉区域。最后,通过丘脑作为中转站,信号被送到大脑皮层,提取出和生物相关的要素,和来自其他感觉系统的信号进行多感官整合。[8]
运动控制
运动系统是脑中直接或间接与运动控制相关的区域,负责支配肌肉。除了负责眼球运动的肌肉是受到中脑的核团控制以外,身体的所有自主控制肌肉都是由脊髓和菱脑中的运动神经元控制的。[8]脊髓的运动神经元既受到脊髓中自有的神经回路控制,也受到脑的下行输入的调控。脊髓神经回路包含许多反射反应,也包含产生行走或游泳所需要节律的中枢模式发生器。而来自脑的下行联结会提供更多的自主控制。[8]
脑包含了若干直接投射到脊髓的运动区域。其中最底层的是延髓和桥脑的运动区域,控制一些刻板运动,例如行走、呼吸和吞咽。在中脑里的运动区域要高级一些,例如负责手脚协调运动的红核。更高级的层级是初级运动皮质,位于额叶后部的一条神经组织。初级运动皮层投射到皮层下运动区域,也通过锥体束大量投射到脊髓。皮层脊髓投射使得精确地自主控制运动的细节变得可能。其他运动相关的脑区通过投射到初级运动区域产生次要的作用,其中最重要的区域是前运动皮质、基底核和小脑。[8]
| 区域名称 | 位置 | 功能 |
|---|---|---|
| 前灰质柱 | 脊髓 | 包含直接触发肌肉的运动神经元[91] |
| 动眼神经核 | 中脑 | 包含直接驱动眼部肌肉的神经元[92] |
| 小脑 | 菱脑 | 提供运动的精确性和时间准确性[8] |
| 基底核 | 前脑 | 动作的选择[93] |
| 运动皮质 | 额叶 | 直接从皮层激活脊髓的运动回路 |
| 前运动皮质 | 额叶 | 将单独的运动整理为协调的运动模式[8] |
| 运动辅助区 | 额叶 | 运动序列的时间模式[94] |
| 前额叶皮质 | 额叶 | 计划和其他管控功能[95] |
除了上述的区域以外,脑和脊髓还包括控制自主神经系统的控制回路,通过分泌荷尔蒙和调节内脏的平滑肌产生作用。[8]自主神经系统控制心率、消化作用、呼吸率、唾液、汗液、尿液的排出,以及性唤起等等。大部分功能都是不直接受自主控制的。
觉醒
对于动物来说,睡眠和清醒交替的昼夜周期也许是它们最明显的行为了。唤醒与警戒也会受到特定脑区在更精细的时间尺度上的调节。[8]
觉醒系统的关键部分是视交叉上核(SCN),下丘脑中的一个小部分,位于双眼视神经交叉点的上方。SCN包含了身体的中枢生物钟,其中的神经元表现出以24小时为周期的活动涨落,也就是昼夜节律:这些涨落活动是由一组“时钟基因”的表达产生的节律而引起的。即使是把SCN从脑中取出,放置于温暖的营养液中,只要它还能照常通过视网膜下视丘路径接收到来自视神经的信号,每天的昼夜循环就能继续工作。[96]
SCN投射到包括海马体、脑干和中脑等和睡眠-清醒循环相关的区域。其中一个重要的部分是网状结构,一组零散地分散在脑底部核心区域的神经细胞群落。网状结构的神经元向丘脑发送信号,而丘脑接下来将控制激活水平的信号发送到皮层的每个部分。网状结构的破坏会导致永久的昏迷。[8]
睡眠会导致脑活动的巨大变化。[8]直到1950年代,人们大多相信在睡眠期间脑是基本上处于关闭状态的,[97]现在人们知道这和事实差距很大;脑活动在睡眠时继续,但是模式变得非常不同。睡眠可以分为两种类型:“快速眼动睡眠(REM,会产生梦)和非快速动眼睡眠(non-REM,通常没有梦),在一个睡眠周期之内以稍有变化的模式反复出现。可以记录到睡眠期间3种不同的脑活动模式:REM,浅度nREM和深度nREM。深度nREM睡眠也被称为慢波睡眠,此时脑皮层呈现大幅的同步活动波,而清醒时则是非同步且充满噪音。神经递质去甲肾上腺素和血清素在慢波睡眠期间降低,在REM睡眠期间几乎为0,而乙酰胆碱的变化水平则呈现相反的趋势。[8]
稳态

对于所有动物来说,将体内的许多参数的波动维持在一定水平内是生存的必须:例如体温、水含量、血流中的含盐量、血糖水平、血氧水平等等。 [98]动物调节其内部环境(内环境)的能力,被生理学家克洛德·贝尔纳命名为稳态(Homeostasis,古希腊语意为“稳定”),[99]保持稳态是脑的一项关键功能。稳态的基本原则是负反馈:一旦一个参数超过它的阈值,感受器就会发送一个误差信号,触发一个反馈,使得该参数回复到之前的最佳水平。[98](这个方法在工程上有广泛应用,例如控制温度的自动调温器 。)
对于脊椎动物来说,在这方面起重要作用的是下丘脑,前脑中的一个小区域,其尺寸与它的复杂性和重要性不成比例。[98]下丘脑包含了许多小核团,其中大多数都和基本的生物功能有关。其中一些功能和觉醒或者社交有关,例如性行为、攻击或者母性行为;其中也有很多和稳态有关。一些下丘脑核团接收来自血管中的感受器的信息,包括温度、盐含量、血糖水平、血氧水平等参数。而下丘脑核团向运动区域释放信号,以产生修正偏差的行为。一些输出会到达脑下垂体,在下丘脑下方和脑相连接的一个小腺体。脑下垂体会分泌荷尔蒙进入血流,进入身体循环并且促进细胞活动的变化。[100]
动机
根据进化论,个体的行为会被编写为确保生存和成功繁殖后代。遗传适应的总的目标,会被转化为一系列以生存为目的的行为,例如寻找食物、水、庇护所和同伴。[101]脑的动机系统通过改变现有环境来满足这些需求,并且激活行为以满足新产生的需求。动机系统基本上是以奖惩机制的方式运作的。当一个特定行为之后跟随着快乐,脑中的奖励机制就开启了,它会导致脑的结构改变,导致如果类似的情形出现时会进行同样的动作。相反地,如果某一个行为之后紧接着痛苦感受,脑中的惩罚机制开启,使得在将来遇到类似环境的时候不再做这样的行为。[102]
至今为止,得到研究的大部分动物都利用了奖惩机制:例如,蠕虫和昆虫都可以通过改变行为来寻找食物和躲避危险。[103]对于脊椎动物来说,奖惩机制由脑中的一个特别部分负责,其核心部位是基底核,位于前脑底部的一个互相连接的部分。[48]有许多证据证明基底核是完成决定过程的关键区域:基底核可以对脑中大部分动作区域进行抑制,当某方面抑制解除后,动作系统就可以执行它们的运动。 奖惩功能通过改变基底核的输入和它释放的决策信号之间的关系起作用。奖励机制比惩罚机制得到了更好的研究,因为它在药物滥用中的角色引发了深入的研究。研究表明神经递质多巴胺起着关键作用:成瘾药物如可卡因、安非他命和尼古丁会导致多巴胺水平上升或者多巴胺的效果被加强。[104]
学习与记忆
几乎所有的动物都有能力根据经验来修改他们的行为——即使是最原始的蠕虫。因为行为是由脑活动所控制,所以行为的变化必定和脑内的变化相关。从学者圣地亚哥·拉蒙-卡哈尔就开始有人认为,学习和记忆最可能的机制是神经元之间的突触联结变化。[105]然而直到1970年代,支持突触可塑性的经验证据仍然缺乏。1971年,蒂莫西·布利斯和泰耶·勒莫发表了我们今天称之为长期增强作用的现象的论文:论文展示了明确的证据,表明动作导致的突触改变可以保持至少几天。[106]尽管技术进步使得这一类实验更容易进行,上千项研究厘清了突触变化的机制,也揭示了其他种类的行为导致突触变化的机制,发生在脑的不同区域,包括大脑皮层、海马体、基底核和小脑。[107]脑源性神经营养因子(BDNF)与体能锻炼可能在其中扮演着促进性的作用。[108]
神经生物学家目前将学习和记忆分为许多种类,对应脑中的不同实现方式:
- 工作记忆 是动物的脑保持关于当下任务的一些暂时信息的能力。这一类动态记忆被认为是受到赫布理论效应的调制:一组激活的神经元会保持同步互相激活。[109]
- 情节记忆 是回忆起特定事件的细节的能力。这一类记忆可以终身保持。许多证据表明,海马体在其中起着关键作用:许多有海马体损伤的人会表现出失忆症,无法获得新的长期情节记忆。[110]
- 语义记忆 是学习事实和关系的能力。这一类记忆可能主要储存在大脑皮质中,通过改变神经元联结来存储特定种类的记忆。[111]
- 工具学习 是根据奖惩来改变行为的能力。它由以基底核为中心的脑区网络实现。[112]
- 动作学习 是通过练习或者单纯的重复来改善身体运动模式的能力。许多脑区和它相关,包括前运动区、基底核,特别重要的是小脑,它的包含了许多关于运动参数的微小调节。[113]
发育
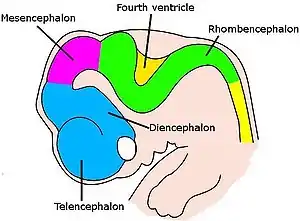
脑并不是简单地长大,而是经过了复杂的协同和一系列步骤。[114]它多次改变形状,从最早期胚胎时的神经索前端的一个简单的膨大,到复杂的区域与联结的组合。 神经元是在一个包含干细胞的特别部位产生出来,穿过组织迁移到它的最终位置。当神经元到达既定位置,它们的轴突就开始伸长、分叉,被引导着穿过脑,直到其末端到达其目的地并且形成突触联结。在神经系统的很多部分中,在初期会形成非常多的神经元和突触,然后其中无用的会被除去。[114]
对于所有种类的脊椎动物来说,神经发育的早期阶段都是类似的。[114]随着胚胎从球形的一团细胞变成蠕虫形状的结构,外胚层中位于背面正中的一条窄带分化为神经板,它是神经系统的前身。神经板向内凹陷形成了神经沟,然后神经沟的边缘融合形成了神经管,一条充满液体的中空细胞管。在这条细胞管的前端出现了三个膨大的囊,分别是前脑、中脑、菱脑的前身。在下一个阶段里,前脑分为两个部分,分别是大脑,包含大脑皮质、基底核和相关结构;以及间脑,包含丘脑和下丘脑。几乎同时,菱脑分裂为后脑,包括小脑和桥脑;与末脑,包括延髓。以上每一个区域都包含了产生神经元和胶质细胞的增生区域,新生的细胞会发生迁移,有时会发生长距离迁移到达其最终目的地。[114]
一旦神经元到达了目的地,它就会向周围伸出许多树突和一根轴突。由于轴突通常会延伸到距离细胞体很远的地方,而且需要到达特定的目的地,所以会以特别复杂的方式生长。生长中的轴突顶端有一小团原生质,称为生长锥,上面分布着化学受体。这些化学受体能够感受周围环境,引导生长锥被各种细胞因素吸引或者排斥,从而沿着特定的路径被引导到应有的位置。这个引导过程的结果,就是生长锥被指引着穿过脑到达其目标区域,然后其他化学信号导致其形成突触。考虑整个脑,上千个基因的产物参与了轴突的引导。 [114]
最终成型的突触网络,只是部分由基因决定。在脑的许多部分中,轴突开始会“过量生长”,然后会根据神经活动来启动“修建”机制。[114]例如,在成年人从眼到中脑的投射中,包含了非常精确的映射,视网膜表面的每一个点都能够在中脑中某一层找到对应的点。在发育的最初阶段,来自视网膜的每一个轴突会被化学信号引导到中脑的大致区域,然后形成众多分叉,覆盖一个宽广区域内的中脑神经元。视网膜有一种特殊的机制:在出生之前。它可以自发地随机产生波动活动,然后缓慢地沿着视网膜增殖。这些波动通过激发邻近的神经元活动而起作用,产生的神经活动模式中包含了神经元的空间排列信息。中脑利用这个信息,判断一些轴突的激活与突触后细胞不一致,从而造成它们的弱化甚至消失。这个精巧的过程会导致映射的逐渐调节和紧缩,最后形成了成人的投射结构。[115]
在其他的脑区也进行着同样的过程:基因决定的化学引导形成了初始的突触矩阵,然后逐渐地受到活动决定的调节机制影响;它一部分是由内源动力驱动,另一部分来自于外界感官输入。在一些情况下,类似视网膜-中脑系统,形成活动模式的机制仅仅在脑发育期间起作用,它显然只是为了引导发育而存在。[115]
对于人类和许多其他动物来说,新的神经元主要是在出生前形成的,新生儿的脑细胞总量要明显多于成人的。[114]然而,也有少数区域终身都会不断产生新的神经元。成年人的神经发生出现在两个区域,一个是和嗅觉有关的嗅球,另一个是海马体中的齿状回,有证据表明新生的神经元在形成新的记忆方面有作用。除了这些例外,在幼年形成的神经元就和终身的神经元一致。但是神经胶质细胞有所不同,体内的各类神经胶质细胞终身都会不断产生。[116]
关于心灵的品质、人格和智力是遗传的还是后天的,一直存在争论,这就是先天与后天的争论。[117]虽然还存在许多疑问,但是神经科学研究已经证明这两个因素都很重要。基因决定了脑的基本结构,也决定了脑如何处理经验。而经验对于调制突触联结网络是必要的,它包含了比基因组要多得多的发育信息。在某些区域,在发育关键时期是否有经验输入是决定性因素。[118]在其他区域,经验的数量和质量很重要;例如,有证据表明在环境丰容的条件下成长的动物大脑皮质会更厚,表明它们比环境受限制的动物拥有更高的突触联结密度。[119]
研究

神经科学的领域包含所有试图理解脑和其余神经系统的工作。[8]心理学试图理解心灵和行为,神经内科学是诊断和治疗神经系统疾病的医学分支。脑也是精神病学研究的最主要器官,它是研究和防治精神病的医学分支。[120]认知科学试图综合神经科学、心理学和其他与脑相关的领域,例如计算机科学(人工智能与类似领域)和哲学。[121]
研究脑最古老的方法是神经解剖学。直到20世纪中叶,神经科学的大部分成果来自于更好的细胞染色技术和更好的显微镜。神经解剖学研究脑的大尺度结构和神经元及其组成部分的微观结构,特别是突触。和其他工具比起来,他们使用了非常多的染色技术,揭示了神经元的结构、化学性质和联结。近年来,免疫染色技术的出现,可以展示神经元中表达某组基因的特定部分。同样,使用医学影像技术的“功能神经解剖学”技术将人脑的许多结构和不同的认知行为联系起来。[122]
神经生理学家研究脑的化学、药理学和电性质,他们的主要工具是药物和记录仪。数千种从实验中开发的药物会对神经系统起作用,其中一些会以高度特化的方式进行。脑的活动可以通过电极来记录,电极可以贴在头皮上作脑电图研究,也可以植入动物的脑中作细胞外电极记录,它可以检测到单个神经元的动作电位。[123]因为脑不包含痛觉感受器,所以使用这些技术记录清醒的动物的脑活动而不引起疼痛是可能的。同样的技术有时会用于研究患有顽固性癫痫的病人的脑活动,如果病人有医学上的必要通过植入电极来定位和癫痫发作相关的脑区域。[124]功能性成像技术,例如fMRI也会在脑的研究中使用;这类技术主要适用于人类,因为它要求清醒的被试长期处于静止状态,但是它们的巨大优点是其非侵入性。[125]
.jpg.webp)
另一个研究脑功能的手段,是检查特定区域脑损伤的后果。虽然脑有颅骨和脑膜保护,由脑脊液包围,并且由血脑屏障将其与血液循环隔离,但是脑的结构脆弱,容易遭受各种疾病和损伤。人类各类中风和其他脑损伤的后果,成为了了解脑功能的关键来源。 由于自然的损伤不像实验中那样可控,所以解释这些信息通常是困难的。在对动物例如大鼠的研究中,可以使用电极或者药物注射来造成特定区域的脑损坏,以检查其对行为的影响。[127]
计算神经科学包含两类研究:一,使用计算机来研究脑;二,研究脑如何进行计算。一方面,可以通过描述一组神经元电化学特性的方程式序列,编写计算机程序来模拟其行为;这样的模拟被称作生物神经网络。另一方面,也可以通过模拟或者数学分析来将神经元复杂的生物学性质抽象为简单的“单元”,来研究神经计算的算法。计算机科学家和神经科学家都有在研究脑的计算功能。[128]
近年来,基因和基因组技术在脑研究上的应用正在增加, [129]集中在神经营养因子的角色及其在神经可塑性中的物理作用。[108] 其最常用的实验对象是小鼠,因为它适用的技术工具很多。如今,人们可以相对简单地“敲掉”或者改变许多种类的基因,然后检验其对脑功能的影响。人们也开始使用更先进的技术,例如Cre-Lox重组系统,可以控制脑中特定部分的基因在特定时间激活或者不激活。[129]
历史
现今发现最古老的人脑来自亚美尼亚的Areni-1洞穴群。它大约有5000年历史,来自一名12-14岁女性的颅骨。虽然脑已经干缩,但是因为山洞中的气候条件而保存得很好。[130]
早期的哲学家对于灵魂位于脑还是心发生了分歧。亚里士多德认为灵魂位于心脏,认为脑的功能只是冷却血液。德谟克利特,原子理论的创始人,认为灵魂分为三部分,智力位于头部、情感位于心脏,而欲望属于肝脏。[131]希波克拉底,“医学之父”,明确地支持脑。在他对癫痫的论断中写道:
人们应该知道,欢乐、喜悦、笑和运动、以及悲伤、痛苦、沮丧和哀恸都来自于脑而非其它任何地方……因为这个器官,我们变得疯狂和错乱,畏惧和恐怖在白昼或者夜晚攻击我们,我们做梦、不时走神,关心不该关心的事情,忽略当下的状况、变得颓废和笨拙。我们承受的所有这些都是出于脑,当它不再健康……
罗马医师盖伦也强调了脑的重要性,建立了具有一定深度的脑工作的理论。盖伦追踪了脑、神经和肌肉的解剖关系,提出身体的所有肌肉都通过神经分叉的网络和脑相连。他假设神经元通过携带一种神秘的物质来激活肌肉,他称之为“pneumata psychikon”,通常翻译为“动物灵气”。[131]盖伦的理论在中世纪广为人知,但是直到文艺复兴都没有进一步的发展。文艺复兴时期精细的解剖研究重新恢复,伴随着勒内·笛卡尔及其追随者的理论构想。 笛卡尔和盖伦一样,用液体管道的方式来理解神经系统。他认为最高的认知能力是通过一种非物质的思维实体(res cogitans)携带的,但是人类的大多数行为,以及动物的所有行为,都可以通过物质机制来解释。[133]
接近现代神经功能理解的第一个真正的成就,是来自路易吉·伽伐尼的研究,他发现对死青蛙腿上暴露的神经进行电击,会导致青蛙腿收缩。从这个时代开始,每一次认识的进步或多或少都是新的研究技术发展的直接产物。直到20世纪初期,最重要的进展来源于新的染色技术。[134]其中特别重要的是高尔基染色,如果使用得当,它可以只染色一小撮神经元,但是会将整个细胞染色,包括胞体、树突和轴突。如果没有这种染色方法,显微镜下的脑组织看起来就是一团无法分辨的互相纠缠的原生质纤维,无法分辨出任何结构。在卡米洛·高尔基,以及西班牙神经解剖学家圣地亚哥·拉蒙-卡哈尔手中,新的染色技术揭示了上百种不同种类的神经元,每一种都有其独有的树突结构和联结模式。[135]

在20世纪上半叶,电子技术的进步促进了神经细胞的电性质的研究,包括艾伦·劳埃德·霍奇金、安德鲁·赫胥黎等对于动作电位的生物物理学工作、伯纳德·卡茨等人对于突触的电化学性质的研究。[136]这些研究将脑的解剖图补完成为了动力学上的实体。1942年,查尔斯·斯科特·谢灵顿对于脑从睡眠中觉醒的描述,反映了这些新的观点:
在这块世上最伟大的物质中,先前还几乎没有一点光线闪烁或者移动,现在已经布满了闪耀着节奏的光点,火花组成的列车匆匆地来来往往。脑正在醒来,意识正在回归。就像银河跳起了宇宙的舞蹈。脑迅速变成了魔法织布机,亿万支飞梭编织着繁复的图案,充满意义但从不重复;每一个细节都保持和谐。
- —谢灵顿, 1942, 《人与人性》(Man on his Nature)[137]
在20世纪下半叶,化学、电子显微技术、基因、计算机科学、功能脑成像和其他领域的进步为脑的结构和功能打开了新的窗户。在美国,1990年代被官方定为脑的十年以纪念脑科学研究的进展,并且增加了这些研究的经费。[138]
这些趋势在21世纪得到了延续,一些新的技术也变得广为人知,包括多电极阵列,可以在同一时刻记录多个脑细胞的活动;[139]基因工程,可以在实验中改变脑的分子构成;[129]基因组学,可以将脑结构的变化和DNA特征的变化[140]和神经成像联系起来。
參考文獻
- Saladin, Kenneth. 3rd. McGraw-Hill. 2011: 416. ISBN 978-0-07-122207-5.
- von Bartheld, CS; Bahney, J; Herculano-Houzel, S. . The Journal of Comparative Neurology. 15 December 2016, 524 (18): 3865–3895. PMC 5063692. PMID 27187682. doi:10.1002/cne.24040.
- Yuste, Rafael; Church, George M. [大腦的新世紀] (PDF). Scientific American. March 2014, 310 (3): 38–45. Bibcode:2014SciAm.310c..38Y. PMID 24660326. doi:10.1038/scientificamerican0314-38. (原始内容 (PDF)存档于2014-07-14).
- Shepherd, GM. [神经生物学]. Oxford University Press. 1994: 3. ISBN 978-0-19-508843-4.
- Sporns, O. [腦的網絡]. MIT Press. 2010: 143. ISBN 978-0-262-01469-4.
- Başar, E. [腦-身-心的含糊笛卡爾系統:由振盪的綜合方法]. Springer. 2010: 225. ISBN 978-1-4419-6134-1.
- Singh, I. . [人類神經解剖學教科書]. Jaypee Brothers. 2006: 24. ISBN 9788180618086.
- Kandel, Eric R.; Schwartz, James Harris; Jessell, Thomas M. [神經科學原理]. New York: McGraw-Hill. 2000. ISBN 978-0-8385-7701-1. OCLC 42073108.
- Douglas, RJ; Martin, KA. [新皮層的神經元電路]. Annual Review of Neuroscience. 2004, 27: 419–451. PMID 15217339. doi:10.1146/annurev.neuro.27.070203.144152.
- Barnett, MW; Larkman, PM. . Practical Neurology. 2007, 7 (3): 192–197. PMID 17515599.
- Shepherd, GM. . [大腦突觸組織]. Oxford University Press US. 2004. ISBN 978-0-19-515956-1.
- Williams, RW; Herrup, K. [神經元數量的控制]. Annual Review of Neuroscience. 1988, 11: 423–453. PMID 3284447. doi:10.1146/annurev.ne.11.030188.002231.
- Heisenberg, M. [蘑菇體回憶錄:從地圖到模型]. Nature Reviews Neuroscience. 2003, 4 (4): 266–275. PMID 12671643. doi:10.1038/nrn1074.
- Jacobs, DK; Nakanishi, N; Yuan, D; 等. . Integrative & Comparative Biology. 2007, 47 (5): 712–723 [2015-09-07]. PMID 21669752. doi:10.1093/icb/icm094. (原始内容存档于2010-03-24).
- Balavoine, G. . Integrative & Comparative Biology. 2003, 43 (1): 137–147. doi:10.1093/icb/43.1.137.
- Schmidt-Rhaesa, A. . Oxford University Press. 2007: 110. ISBN 978-0-19-856669-4.
- Kristan Jr, WB; Calabrese, RL; Friesen, WO. . Prog Neurobiology. 2005, 76 (5): 279–327. PMID 16260077. doi:10.1016/j.pneurobio.2005.09.004.
- Mwinyi, A; Bailly, X; Bourlat, SJ; Jondelius, U; Littlewood, DT; Podsiadlowski, L. . BMC Evolutionary Biology. 2010, 10: 309. PMC 2973942. PMID 20942955. doi:10.1186/1471-2148-10-309.
- Barnes, RD. 5th. Saunders College Pub. 1987: 1. ISBN 978-0-03-008914-5.
- Butler, AB. . Anatomical Record. 2000, 261 (3): 111–125. PMID 10867629. doi:10.1002/1097-0185(20000615)261:3<111::AID-AR6>3.0.CO;2-F.
- Bulloch, TH; Kutch, W. . Breidbach O (编). . Birkhäuser. 1995: 439. ISBN 978-3-7643-5076-5.
- . [2011-10-14]. (原始内容存档于2016-05-16).
- Konopka, RJ; Benzer, S. . Proc. Natl. Acad. Sci. U.S.A. 1971, 68 (9): 2112–6. PMC 389363. PMID 5002428. doi:10.1073/pnas.68.9.2112.
- Shin, Hee-Sup; 等. . Nature. 1985, 317 (6036): 445–8. PMID 2413365. doi:10.1038/317445a0.
- Heisenberg, M; Heusipp, M; Wanke, C. . J. Neurosci. 1995, 15: 1951–1960.
- . [2011-10-14]. (原始内容存档于2011-10-11).
- Hobert, O. The C. elegans Research Community , 编. . WormBook. 2005: 1–19 [2010-06-14]. PMID 18050401. doi:10.1895/wormbook.1.12.1. (原始内容存档于2011-07-17).
- White, JG; Southgate, E; Thomson, JN; Brenner, S. . Philosophical Transactions of the Royal Society B. 1986, 314 (1165): 1–340. PMID 22462104. doi:10.1098/rstb.1986.0056.
- Jabr, Ferris. . Scientific American. 2012-10-02 [2014-01-18].
- Hodgkin, J. . Brenner S, Miller JH (编). . Elsevier. 2001: 251–256. ISBN 978-0-12-227080-2.
- Kandel, ER. . WW Norton. 2007: 145–150. ISBN 978-0-393-32937-7.
- Shu, D.-G.; Conway Morris, S.; Han, J.; Zhang, Z.-F.; Yasui, K.; Janvier, P.; Chen, L.; Zhang, X.-L.; Liu, J.-N.; 等. . Nature. 2003, 421 (6922): 526–529. PMID 12556891. doi:10.1038/nature01264.
- Striedter, GF. . . Sinauer Associates. 2005. ISBN 978-0-87893-820-9.
- Armstrong, E. . Science. 1983, 220 (4603): 1302–1304. PMID 6407108. doi:10.1126/science.6407108.
- Jerison, HJ. . Academic Press. 1973: 55–74. ISBN 978-0-12-385250-2.
- Parent, A; Carpenter, MB. . . Williams & Wilkins. 1995. ISBN 978-0-683-06752-1.
- Pardridge, W. . NeuroRx. 2005, 2 (1): 3–14. PMC 539316. PMID 15717053. doi:10.1602/neurorx.2.1.3.
- Northcutt, RG. . Brain Research Bulletin. 2008, 75 (2–4): 191–205. PMID 18331871. doi:10.1016/j.brainresbull.2007.10.058.
- Reiner, A; Yamamoto, K; Karten, HJ. . The Anatomical Record Part A. 2005, 287 (1): 1080–1102. PMID 16206213. doi:10.1002/ar.a.20253.
- Siegel, A; Sapru, HN. . Lippincott Williams & Wilkins. 2010: 184–189. ISBN 978-0-7817-8383-5.
- Swaab, DF; Boller, F; Aminoff, MJ. . Elsevier. 2003. ISBN 978-0-444-51357-1.
- Jones, EG. . Plenum Press. 1985. ISBN 978-0-306-41856-3.
- Knierim, James. "Cerebellum (Section 3, Chapter 5) Neuroscience Online: An Electronic Textbook for the Neurosciences | Department of Neurobiology and Anatomy - The University of Texas Medical School at Houston." Cerebellum (Section 3, Chapter 5) Neuroscience Online: An Electronic Textbook for the Neurosciences | Department of Neurobiology and Anatomy - The University of Texas Medical School at Houston. The University of Texas Health Science Center at Houston (UTHealth), 2015. Web. 2 June 2015.
- Saitoh, K; Ménard, A; Grillner, S. . Journal of Neurophysiology. 2007, 97 (4): 3093–3108. PMID 17303814. doi:10.1152/jn.00639.2006.
- Richard Swann Lull; Harry Burr Ferris; George Howard Parker; James Rowland Angell; Albert Galloway Keller; Edwin Grant Conklin. . Yale University Press. 1922: 50.
- Puelles, L. . Philosophical Transactions of the Royal Society B. 2001, 356 (1414): 1583–1598. PMC 1088538. PMID 11604125. doi:10.1098/rstb.2001.0973.
- Salas, C; Broglio, C; Rodríguez, F. . Brain, Behavior and Evolution. 2003, 62 (2): 72–82. PMID 12937346. doi:10.1159/000072438.
- Grillner, S; 等. . Trends in Neurosciences. 2005, 28 (7): 364–370. PMID 15935487. doi:10.1016/j.tins.2005.05.004.
- Northcutt, RG. . Annual Review of Neuroscience. 1981, 4: 301–350. PMID 7013637. doi:10.1146/annurev.ne.04.030181.001505.
- Northcutt, RG. . Integrative & Comparative Biology. 2002, 42 (4): 743–756. PMID 21708771. doi:10.1093/icb/42.4.743.
- Barton, RA; Harvey, PH. . Nature. 2000, 405 (6790): 1055–1058. PMID 10890446. doi:10.1038/35016580.
- Aboitiz, F; Morales, D; Montiel, J. . Behavioral and Brain Sciences. 2003, 26 (5): 535–552. PMID 15179935. doi:10.1017/S0140525X03000128. (原始内容存档于2008-08-07).
- Romer, AS; Parsons, TS. . Holt-Saunders International. 1977: 531. ISBN 0-03-910284-X.
- Roth, G; Dicke, U. . Trends in Cognitive Sciences. 2005, 9 (5): 250–257. PMID 15866152. doi:10.1016/j.tics.2005.03.005.
- Marino, Lori. (PDF). International Society for Comparative Psychology. 2004, (17): 1–16 [2010-08-29]. (原始内容 (PDF)存档于2018-09-16).
- Shoshani, J; Kupsky, WJ; Marchant, GH. . Brain Research Bulletin. 2006, 70 (2): 124–157. PMID 16782503. doi:10.1016/j.brainresbull.2006.03.016.
- Finlay, BL; Darlington, RB; Nicastro, N. . Behavioral and Brain Sciences. 2001, 24 (2): 263–308. PMID 11530543. doi:10.1017/S0140525X01003958.
- Johanson, D. C.(1996). From Lucy to language. New York: Simon and Schuster, p. 80.
- Murre, J.; Sturdy, D. . Biological cybernetics. 1995, 73 (6): 529–545. PMID 8527499. doi:10.1007/BF00199545.
- Calvin, WH. . Basic Books. 1996. ISBN 978-0-465-07278-1.
- Sereno, MI; Dale, AM; Reppas, AM; Kwong, KK; Belliveau, JW; Brady, TJ; Rosen, BR; Tootell, RBH. (PDF). Science (AAAS). 1995, 268 (5212): 889–893. PMID 7754376. doi:10.1126/science.7754376.
- Fuster, JM. . Elsevier. 2008: 1–7. ISBN 978-0-12-373644-4.
- Cooper, JR; Bloom, FE; Roth, RH. . Oxford University Press US. 2003. ISBN 978-0-19-514008-8.
- McGeer, PL; McGeer, EG. . G. Siegel; 等 (编). . Raven Press. 1989: 311–332. ISBN 978-0-88167-343-2.
- Foster, AC; Kemp, JA. . Current Opinion in Pharmacology. 2006, 6 (1): 7–17. PMID 16377242. doi:10.1016/j.coph.2005.11.005.
- Frazer, A; Hensler, JG. . Siegel, GJ (编). Sixth. Lippincott Williams & Wilkins. 1999. ISBN 0-397-51820-X.
- Mehler, MF; Purpura, DP. . Brain Research Reviews. 2009, 59 (2): 388–392. PMC 2668953. PMID 19059284. doi:10.1016/j.brainresrev.2008.11.001.
- Rang, HP. . Churchill Livingstone. 2003: 476–483. ISBN 0-443-07145-4.
- Speckmann, E-J; Elger, CE. . Niedermeyer E, Lopes da Silva FH (编). . Lippincott Williams & Wilkins. 2004: 17–31. ISBN 0-7817-5126-8.
- Buzsáki, G. . Oxford University Press. 2006. ISBN 978-0-19-530106-9. OCLC 63279497.
- Nieuwenhuys, R; Donkelaar, HJ; Nicholson, C. . Springer. 1998: 11–14. ISBN 978-3-540-56013-5.
- Safi, K; Seid, MA; Dechmann, DK. . Biology Letters. 2005, 1 (3): 283–286. PMC 1617168. PMID 17148188. doi:10.1098/rsbl.2005.0333.
- Mink, JW; Blumenschine, RJ; Adams, DB. . American Journal of Physiology. 1981, 241 (3): R203–212. PMID 7282965.
- Raichle, M; Gusnard, DA. . Proc. Natl. Acad. Sci. U.S.A. 2002, 99 (16): 10237–10239. PMC 124895. PMID 12149485. doi:10.1073/pnas.172399499.
- Mehagnoul-Schipper, DJ; Van Der Kallen, BF; Colier, WNJM; Van Der Sluijs, MC; Van Erning, LJ; Thijssen, HO; Oeseburg, B; Hoefnagels, WH; Jansen, RW. . Hum Brain Mapp. 2002, 16 (1): 14–23. PMID 11870923. doi:10.1002/hbm.10026.
- Ebert, D.; Haller, RG.; Walton, ME. . J Neurosci. Jul 2003, 23 (13): 5928–35. PMID 12843297.
- Marin-Valencia, I.; Good, LB.; Ma, Q.; Malloy, CR.; Pascual, JM. . J Cereb Blood Flow Metab. Feb 2013, 33 (2): 175–82. PMC 3564188. PMID 23072752. doi:10.1038/jcbfm.2012.151.
- Boumezbeur, F.; Petersen, KF.; Cline, GW.; Mason, GF.; Behar, KL.; Shulman, GI.; Rothman, DL. . J Neurosci. Oct 2010, 30 (42): 13983–91. PMC 2996729. PMID 20962220. doi:10.1523/JNEUROSCI.2040-10.2010.
- Deelchand, DK.; Shestov, AA.; Koski, DM.; Uğurbil, K.; Henry, PG. . J Neurochem. May 2009,. 109 Suppl 1 (Suppl 1): 46–54. PMC 2722917. PMID 19393008. doi:10.1111/j.1471-4159.2009.05895.x.
- Soengas, JL; Aldegunde, M. . Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology. 2002, 131 (3): 271–296. PMID 11959012. doi:10.1016/S1096-4959(02)00022-2.
- Carew, TJ. . . Sinauer Associates. 2000. ISBN 978-0-87893-092-0.
- Churchland, PS; Koch, C; Sejnowski, TJ. . Schwartz EL (编). . MIT Press. 1993: 46–55. ISBN 978-0-262-69164-2.
- von Neumann, J; Churchland, PM; Churchland, PS. . Yale University Press. 2000: xi–xxii. ISBN 978-0-300-08473-3.
- Lettvin, JY; Maturana, HR; McCulloch, WS; Pitts, WH. (PDF). Proceedings of the Institute of Radio Engineering. 1959, 47: 1940–1951. doi:10.1109/jrproc.1959.287207. (原始内容 (pdf)存档于2011-09-28).
- Hubel, DH; Wiesel, TN. . Oxford University Press US. 2005: 657–704. ISBN 978-0-19-517618-6.
- Farah, MJ. . Wiley-Blackwell. 2000: 1–29. ISBN 978-0-631-21403-8.
- Engel, AK; Singer, W. . Trends in Cognitive Sciences. 2001, 5 (1): 16–25. PMID 11164732. doi:10.1016/S1364-6613(00)01568-0.
- Dayan, P; Abbott, LF. . . MIT Press. 2005. ISBN 978-0-262-54185-5.
- Averbeck, BB; Lee, D. . Trends in Neurosciences. 2004, 27 (4): 225–230. PMID 15046882. doi:10.1016/j.tins.2004.02.006.
- Forrest, MD. . Frontiers in Computational Neuroscience. 2014, 8: 86 [2015-09-11]. doi:10.3389/fncom.2014.00086. (原始内容存档于2014-10-06).
- Dafny, N. . Neuroscience Online. [2011-10-10]. (原始内容存档于2011-10-08).
- Dragoi, V. . Neuroscience Online. [2011-10-10]. (原始内容存档于2011-11-17).
- Gurney, K; Prescott, TJ; Wickens, JR; Redgrave, P. . Trends in Neurosciences. 2004, 27 (8): 453–459. PMID 15271492. doi:10.1016/j.tins.2004.06.003.
- Shima, K; Tanji, J. . Journal of Neurophysiology. 1998, 80 (6): 3247–3260. PMID 9862919.
- Miller, EK; Cohen, JD. . Annual Review of Neuroscience. 2001, 24 (1): 167–202. PMID 11283309. doi:10.1146/annurev.neuro.24.1.167.
- Antle, MC; Silver, R. (PDF). Trends in Neurosciences. 2005, 28 (3): 145–151. PMID 15749168. doi:10.1016/j.tins.2005.01.003. (原始内容 (PDF)存档于2008-10-31).
- Kleitman, N. . revised 1963, reprinted 1987. The University of Chicago Press, Midway Reprints series. 1938. ISBN 0-226-44073-7.
- Dougherty, P. . Neuroscience Online. [2011-10-11]. (原始内容存档于2011-11-17).
- Gross, CG. (PDF). The Neuroscientist. 1998, 4 (5): 380–385 [2015-09-16]. doi:10.1177/107385849800400520. (原始内容存档 (PDF)于2011-11-17).
- Dougherty, P. . Neuroscience Online. [2011-10-11]. (原始内容存档于2011-11-17).
- Chiel, HJ; Beer, RD. . Trends in Neurosciences. 1997, 20 (12): 553–557. PMID 9416664. doi:10.1016/S0166-2236(97)01149-1.
- Berridge, KC. . Physiology & Behavior. 2004, 8 (2): 179–209. PMID 15159167. doi:10.1016/j.physbeh.2004.02.004.
- Ardiel, EL; Rankin, CH. . Learning and Memory. 2010, 17 (4): 191–201. PMID 20335372. doi:10.1101/lm.960510.
- Hyman, SE; Malenka, RC. . Nature Reviews Neuroscience. 2001, 2 (10): 695–703. PMID 11584307. doi:10.1038/35094560.
- Ramón y Cajal, S. . Proceedings of the Royal Society. 1894, 55 (331–335): 444–468. doi:10.1098/rspl.1894.0063.
- Lømo, T. . Philosophical Transactions of the Royal Society B. 2003, 358 (1432): 617–620. PMC 1693150. PMID 12740104. doi:10.1098/rstb.2002.1226.
- Malenka, R; Bear, M. . Neuron. 2004, 44 (1): 5–21. PMID 15450156. doi:10.1016/j.neuron.2004.09.012.
- Bos, I; De Boever, P; Int Panis, L; Meeusen, R. . Sports Medicine. August 2014, 44: 1505–1518 [2015-09-16]. doi:10.1007/s40279-014-0222-6. (原始内容存档于2014-08-21).
- Curtis, CE; D'Esposito, M. . Trends in Cognitive Sciences. 2003, 7 (9): 415–423. PMID 12963473. doi:10.1016/S1364-6613(03)00197-9.
- Tulving, E; Markowitsch, HJ. . Hippocampus. 1998, 8 (3): 198–204. PMID 9662134. doi:10.1002/(SICI)1098-1063(1998)8:3<198::AID-HIPO2>3.0.CO;2-G.
- Martin, A; Chao, LL. . Current Opinion in Neurobiology. 2001, 11 (2): 194–201. PMID 11301239. doi:10.1016/S0959-4388(00)00196-3.
- Balleine, BW; Liljeholm, Mimi; Ostlund, SB. . Behavioral Brain Research. 2009, 199 (1): 43–52. PMID 19027797. doi:10.1016/j.bbr.2008.10.034.
- Doya, K. . Current Opinion in Neurobiology. 2000, 10 (6): 732–739. PMID 11240282. doi:10.1016/S0959-4388(00)00153-7.
- Purves, Dale.; Lichtman, Jeff W. . Sunderland, Mass.: Sinauer Associates. 1985. ISBN 978-0-87893-744-8. OCLC 10798963.
- Wong, R. . Annual Review of Neuroscience. 1999, 22: 29–47. PMID 10202531. doi:10.1146/annurev.neuro.22.1.29.
- Rakic, P. . J. Neuroscience. 2002, 22 (3): 614–618. PMID 11826088.
- Ridley, M. . Forth Estate. 2003: 1–6. ISBN 978-0-06-000678-5.
- Wiesel, T. (PDF). Nature. 1982, 299 (5884): 583–591. PMID 6811951. doi:10.1038/299583a0.
- van Praag, H; Kempermann, G; Gage, FH. . Nature Reviews Neuroscience. 2000, 1 (3): 191–198. PMID 11257907. doi:10.1038/35044558.
- Storrow, Hugh A. . New York: Appleton-Century-Crofts, Educational Division. 1969. ISBN 978-0-390-85075-1. OCLC 47198.
- Thagard, P. Zalta, EN , 编. . The Stanford Encyclopedia of Philosophy. 2008 [2011-10-14]. (原始内容存档于2018-07-15).
- Bear, MF; Connors, BW; Paradiso, MA. . . Lippincott Williams & Wilkins. 2007. ISBN 978-0-7817-6003-4.
- Dowling, JE. . Harvard University Press. 2001: 15–24. ISBN 978-0-674-00462-7.
- Wyllie, E; Gupta, A; Lachhwani, DK. . . Lippincott Williams & Wilkins. 2005. ISBN 978-0-7817-4995-4.
- Laureys, S; Boly, M; Tononi, G. . Laureys S, Tononi G (编). . Academic Press. 2009: 31–42. ISBN 978-0-12-374168-4.
- Carmena, JM; 等. . PLoS Biology. 2003, 1 (2): 193–208. PMC 261882. PMID 14624244. doi:10.1371/journal.pbio.0000042.
- Kolb, B; Whishaw, I. . . Macmillan. 2008. ISBN 978-0-7167-9586-5.
- Abbott, LF; Dayan, P. . . MIT Press. 2001. ISBN 978-0-262-54185-5.
- Tonegawa, S; Nakazawa, K; Wilson, MA. . Philosophical Transactions of the Royal Society B. 2003, 358 (1432): 787–795. PMC 1693163. PMID 12740125. doi:10.1098/rstb.2002.1243.
- Bower, Bruce. . ScienceNews. 12 January 2009.
- Finger, S. . Oxford University Press. 2001: 14–15. ISBN 978-0-19-514694-3.
-
- Hippocrates, , Translated by Francis Adams, Internet Classics Archive: The University of Adelaide Library, 2006 [400 BCE], (原始内容存档于September 26, 2007)
- Finger, S. . Oxford University Press. 2001: 193–195. ISBN 978-0-19-514694-3.
- Bloom, FE. Schmidt FO, Worden FG, Swazey JP, Adelman G , 编. . MIT Press. 1975: 211. ISBN 978-0-262-23072-8.
- Shepherd, GM. . . Oxford University Press. 1991. ISBN 978-0-19-506491-9.
- Piccolino, M. . Trends in Neurosciences. 2002, 25 (11): 552–553. PMID 12392928. doi:10.1016/S0166-2236(02)02276-2.
- Sherrington, CS. . Cambridge University Press. 1942: 178. ISBN 978-0-8385-7701-1.
- Jones, EG; Mendell, LM. . Science. 1999, 284 (5415): 739 [2015-09-22]. Bibcode:1999Sci...284..739J. PMID 10336393. doi:10.1126/science.284.5415.739. (原始内容存档于2010-06-14).
- Buzsáki, G. (PDF). Nature Neuroscience. 2004, 7 (5): 446–451. PMID 15114356. doi:10.1038/nn1233. (原始内容 (PDF)存档于2011-11-17).
- Geschwind, DH; Konopka, G. . Nature. 2009, 461 (7266): 908–915. Bibcode:2009Natur.461..908G. PMC 3645852. PMID 19829370. doi:10.1038/nature08537.
外部連結
| 维基共享资源中相关的多媒体资源:脑 |
- The Society for Neuroscience 页面存档备份,存于
- IBRO (International Brain Research Organization) 页面存档备份,存于
- The HOPES Brain Tutorial at hopes.stanford.edu
- Comparative Mammalian Brain Collection 页面存档备份,存于
- Brain Research News from ScienceDaily 页面存档备份,存于
- BrainInfo for Neuroanatomy
- Neuroscience for kids 页面存档备份,存于
- BrainMaps.org,互动的高清数字化脑地图,基于灵长类和非灵长类的脑切片的数字化图像。
- The Brain from Top to Bottom
- The Department of Neuroscience at Wikiversity
- The Secret Life of the Brain : History of the Brain 来自PBS
- University of Washington 脑区域的3D图像。
- 7 circuits of the Brain
- head and neck(頭頸部)-大腦溝與迴(cerebral gyru and sulcus)