碲
| 外觀 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
银灰色 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 碲(Tellurium)·Te·52 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 類金屬 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·週期·區 | 16 ·5·p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 127.6(1) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | [氪]4d10 5s2 5p4 2, 8, 18, 18, 6 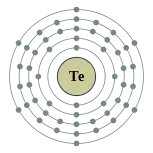 碲的电子層(2, 8, 18, 18, 6) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 發現 | 米勒·冯·赖兴施泰因(1782年) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分離 | Martin Heinrich Klaproth | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 固體 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 6.24 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點時液體密度 | 5.70 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | 722.66 K,449.51 °C,841.12 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 1261 K,988 °C,1810 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | 17.49 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | 114.1 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | 25.73 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸氣壓
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | 6, 5, 4, 2, -2 (弱酸性) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | 2.1(鲍林标度) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:869.3 kJ·mol−1 第二:1790 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半徑 | 140 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | 138±4 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德華半徑 | 206 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 六方[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 抗磁性[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 1.97–3.38 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 聲速(細棒) | (20 °C)2610 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 楊氏模量 | 43 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 16 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 體積模量 | 65 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 2.25 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 180 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 13494-80-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:碲的同位素
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
碲的化学性质与硒及硫类似。主要用作合金及半导体。碲化铋用作热电装置中。
碲-128及碲-130是最常见的碲同位素,但它们兩者都有微弱的放射性。
碲是制造碲化镉太阳能薄膜电池的主要原料。
碲矿资源分布稀散,多伴生在其它矿物中或以杂质形式存在于其它矿中。中国四川石棉县大水沟碲矿是至今发现的唯一碲独立矿床[3]。
发现
碲元素德国矿物学家米勒·冯·赖兴施泰因于1782年在研究德国金矿石时发现。1782年,在奥地利维也纳的一家矿场米勒·冯·赖兴施泰因从矿石中提取出碲,最初他以为是锑,后来发现它的性质与锑不同,而是一种新元素。为了获得其他人的证实,米勒曾将少许样品寄交瑞典化学家柏格曼,请他鉴定。由于样品数量太少,柏格曼只能证明它不是锑而已。
1783年,米勒·冯·赖兴施泰因在罗马尼亚的锡比乌发现。他被来自Zalatna附近的一个矿中的矿石激起了兴趣,它有金属光泽而且他推测其是原生的锑或铋(是碲化金,AuTe2。),初步研究证明了它既不包含锑也不包含铋。Müller研究着这个矿石并证明了它包含一种新的元素。他在一个不著名的杂志上发表了他的发现,但是被当时的科学界忽视了。
1789年,匈牙利科学家Paul Kitaibel送给他了一些,Paul Kitaibel曾独立发现了它。
1796年,他给在柏林的Martin Klaproth送去了一个样本,证明了他的发现。Klaproth生产出纯净的样本并决定叫它tellurium(碲)。相当奇怪的是,这并不是经他手的第一份碲样本。
米勒的发现被忽略了16年后,1798年1月25日克拉普罗特在柏林科学院宣读一篇关于特兰西瓦尼亚的金矿论文时,才重新把这个被人遗忘的元素提出来。他将这种矿石溶解在王水中,用过量碱使溶液部分沉淀,除去金和铁等,在沉淀中发现这一新元素,命名为tellurium(碲),元素符号定为Te。这一词来自拉丁文tellus(地球)。
用途
碲消费量的80%是在冶金工业中应用:钢和铜合金加入少量碲,能改善其切削加工性能并增加硬度;在铸铁中碲被用作碳化物稳定剂,使表面坚固耐磨;含少量碲的铅,可提升材料的耐蚀性、耐磨性和强度,用作海底电缆的护套。
碲可用作石油裂解催化剂的添加剂以及制取乙二醇的催化剂。氧化碲用作玻璃的着色剂。高纯碲可作温差电材料的合金组分。和多数类金属一样,碲和若干碲化物是半导体材料。超纯碲单晶是新型的红外材料。
碲化合物广泛用于合成有机化学中,用于还原和氧化,环官能化,脱卤,碳负离子生成反应和去除保护基团 [5].有机金属化合物是胺,二醇和天然产物合成的中间体[6][7].碲是关键高性能混合氧化物催化剂中的组分,用于丙烷到丙烯酸的非均相催化选择性氧化[8][9]。水蒸气的存在使催化剂表面富含碲和钒,这转化为丙烯酸生产的改进[10][11].碲可用于氨[12]传感器和亚碲酸盐玻璃[13]
同位素
目前已知的碲同位素从105Te直到142Te,其中,存在于自然界的同位素只有8种,稳定的有四种,分别为碲-122,碲-124,碲125,碲-126。碲-120,碲-123,碲-128和碲-130都有很长的半衰期,放射性极为微弱。
参见
参考文献
- Tellurium 页面存档备份,存于, mindat.org
- Magnetic susceptibility of the elements and inorganic compounds 的存檔,存档日期2012-01-12., in Handbook of Chemistry and Physics 81st edition, CRC press.
- . [2010-03-11]. (原始内容存档于2010-10-04).
- 《化学元素综论》. 周公度 叶宪曾 吴念祖 编. 科学出版社. P173. 52 碲 Tellurium. ISBN 978-7-03-035615-4
- Petragnani, Nicola; Wai-Ling, Lo. . Journal of the Brazilian Chemical Society. 1998-09, 9 (5): 415–425. doi:10.1590/S0103-50531998000500002.
- Vargas, Fabricio; Toledo, Fabiano T; Comasseto, João V. . Journal of the Brazilian Chemical Society. 2010, 21 (11): 2072–2078. doi:doi:10.1590/S0103-50532010001100007 请检查
|doi=值 (帮助). - Ferrarini, Renan S.; Princival, Jefferson L.; Comasseto, João V.; Dos Santos, Alcindo A. . Journal of the Brazilian Chemical Society. 2008, 19 (5): 811–812. doi:10.1590/S0103-50532008000500002.
- . ACS Catal. [2018-12-26]. (原始内容存档于2019-03-29) (英语).
- . (PDF) https://depositonce.tu-berlin.de/bitstream/11303/3269/1/Dokument_8.pdf. [2018-12-26]. (原始内容存档 (PDF)于2016-05-30). 缺少或
|title=为空 (帮助) - . Journal of Catalysis. 2014-03, 311: 369–385 [2018-12-26]. (原始内容存档于2020-07-13).
- . Journal of Catalysis. 2012-01, 285 (1): 48–60 [2018-12-26]. (原始内容存档于2020-07-13).
- . [2018-12-26]. (原始内容存档于2018-08-23).
- (PDF). Cerâmica. [2018-12-26]. doi:10.1590%2FS0366-6913200700030018 请检查
|doi=值 (帮助). (原始内容存档 (PDF)于2017-08-22).
外部連結
- 元素碲在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— {{LinkForElement|Te| }}(英文)
- 元素碲在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素碲在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – {{LinkForElement|Te| }}(英文)
