镤
镤(英語:,旧译作鎃[3])是一种放射性化学元素,化学符号为Pa,原子序为91。鏷是一种银灰色、密度大的锕系元素,容易与氧、水蒸汽和无机酸反应。
鏷在自然界中非常稀少,在地壳中的平均浓度是通常为兆分之一,但在一些晶质铀矿的矿床中可能达到百万分之一。鏷因为稀少,具有高放射性和高毒性,除了科学研究之外没有其他用途。由于由于镤和其他锕系元素的化学和物理特性过于接近,难以分离,故目前研究用的鏷主要是从用过核燃料中提炼。鏷寿命最长且最主要的天然同位素为235U的衰变产物231Pa,半衰期为32760年。
历史
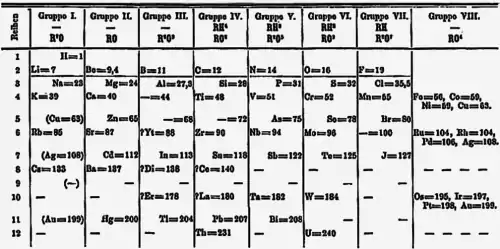
早在1871年,德米特里·门得列夫便预测钍和铀之间有元素的存在,并在週期表中预留位置。[4]由于当时锕系元素还没有被发现,所以在1871版年门得列夫週期表的排序方式中,铀位于第Ⅵ族,钍位于第Ⅳ族中,并在第V组中的钽以下的位置留空。这样的编排方式一直持续到1950年代[5],并造成很长一段时间化学家都积极在寻找与钽相似性质的元素,而使发现镤的机率趋近于零。实际上,下一个与钽有相似化性的元素为人造元素𨧀。
1900年,威廉·克鲁克斯将硝酸铀醯溶解于乙醚中,发现剩馀的水中含有234Th和另一未知强烈放射性物质。他将它从硝酸铀醯分离,这个物质便是镤。但他不知道他发现了一个新的化学元素,并将其命名为铀-X。[4][6][7]
镤真正首次发现于1913年,当时法扬斯和奥斯瓦尔德·格林,在他们的研究的铀-238衰变链(238铀→234钍→234镤→234铀)中,发现了镤的同位素234镤。因为它的半衰期短只有6.7小时,所以他们将他们发现的新元素命名为Brevium(拉丁语,意思是短暂、短期)。
1917年至1918年间,两组科学家奥托·哈恩和莉泽·迈特纳,以及德国和英国的弗雷德里克·索迪和约翰·克兰斯登(John Cranston)的,发现了镤的另一个同位素231镤,半衰期约32000年。因此,他们将名称从Brevium变更为镤(proto-actinium)(希腊文:πρῶτος,意义为之前,首先),因为镤在铀-235衰变链的位置在锕之前。
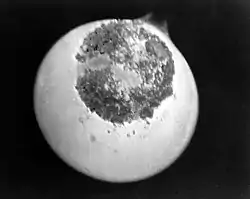
1927年,阿里斯蒂德·冯·格罗斯提取出2毫克的五氧化二镤(Pa2O5),并于1934年首次在0.1毫克的五氧化二镤中分离出纯镤。
英国原子能管理局(UKAEA)在1961年花了50万美元处理了60吨的用过核燃料,提炼出约125克纯度为99.9%的镤[8][9] ,并成为多年来世界上唯一的镤来源,提供给各实验室进行科学研究。[4]镤目前的价格非常昂贵,美国橡树岭国家实验室于2011年公布1克的镤约为280美元。[10]
生成

鏷是天然存在的最罕見和最昂貴元素之一。由於鈾-235的α衰變(產生鏷-231),以及鈾-238的β衰變(產生镤-234),以至於鏷通常是以231Pa和234Pa的形式存在。而幾乎所有的鈾238(99.8%)都會衰變成234mPa。
镤-233是釷-232中子俘獲所形成的。而它會再衰變成鈾-233,或者捕捉另一個中子,並轉換成非裂變的鈾-234。
镤出現在晶質鈾礦(瀝青鈾礦)的濃度約0.3至3百萬分濃度(ppm)。大部分的濃度為0.3ppm,但部分從剛果民主共和國產的礦物約有3ppm。在大多數的天然材料和在水中,鏷以一兆分之一以下的濃度均勻分布,放射性約為0.1微居里/克。
物理及化學性質
物理性質
镤是銀灰色光澤的金屬,可保存於空氣中一段時間。
镤是週期表中位於鈾的左側;釷的右側,而其物理性質正介於這兩個錒系元素之間。镤的密度比釷大,而比鈾輕;其熔點低於釷,而比鈾高。這三個元素的熱膨脹,電導率和導熱程度互相媲美,是典型的“窮金屬”。
在室溫下,镤是體心四方結構,其可以被視為扭曲的體心立方晶格結晶;而這種結構在被壓縮高達53 GPa時仍然不改變。 镤目前已知在任何溫度下具有順磁性而不會轉變磁性。 在溫度低於1.4K時將成為超導體。 在室溫下镤四氯化碳是順磁性的,而冷卻至182K後會變成鐵磁。
化學性質
镤容易與氧,水蒸氣和酸反應,但不與鹼金屬反應。
無論是在固體和水溶液,镤存在兩個主要的氧化態:+4和+5,而+3和+2的狀態存在於一些固相。由於它的電子組態是[Rn]7s26d15f2,+5氧化態對應的低能量有利於5f0的電子填入。+4和+5都狀態很容易在水中形成氫氧化物,主要離子包括Pa(OH)3+, Pa(OH)2+
2, Pa(OH)+
3 a以及 Pa(OH)4,皆無色。其他已知的離子包括PaCl2+
2, PaSO2+
4, PaF3+, PaF2+
2, PaF−
6, PaF2−
7 以及 PaF3−
8。
化合物
| 化學式 | 顏色 | 結構 | 空間群 | 空間群編號 | 皮爾遜符號 | a (pm) | b (pm) | c (pm) | Z | 密度, g/cm3 |
|---|---|---|---|---|---|---|---|---|---|---|
| Pa | 銀灰 | 四方晶系 | I4/mmm | 139 | tI2 | 392.5 | 392.5 | 323.8 | 2 | 15.37 |
| PaO | 岩鹽[11] | Fm3m | 225 | cF8 | 496.1 | 4 | 13.44 | |||
| PaO2 | 黑 | fcc[11] | Fm3m | 225 | cF12 | 550.5 | 4 | 10.47 | ||
| Pa2O5 | 白 | Fm3m[11] | 225 | cF16 | 547.6 | 547.6 | 547.6 | 4 | 10.96 | |
| Pa2O5 | 白 | 斜方晶系[11] | 692 | 402 | 418 | |||||
| PaH3 | 黑 | 立方晶系[11] | Pm3n | 223 | cP32 | 664.8 | 664.8 | 664.8 | 8 | 10.58 |
| PaF4 | 紅棕 | 單斜晶系[11] | C2/c | 15 | mS60 | 2 | ||||
| PaCl4 | 黃綠 | 四方晶系[12] | I41/amd | 141 | tI20 | 837.7 | 837.7 | 748.1 | 4 | 4.72 |
| PaBr4 | 棕 | 四方晶系[13] | I41/amd | 141 | tI20 | 882.4 | 882.4 | 795.7 | ||
| PaCl5 | 黃 | 單斜晶系[14] | C2/c | 15 | mS24 | 797 | 1135 | 836 | 4 | 3.74 |
| PaBr5 | 紅 | 單斜晶系[15] | P21/c | 14 | mP24 | 838.5 | 1120.5 | 1214.6 | 4 | 4.98 |
| PaOBr3 | 單斜晶系 | C2 | 1691.1 | 387.1 | 933.4 | |||||
| Pa(PO3)4 | 斜方晶系[16] | 696.9 | 895.9 | 1500.9 | ||||||
| Pa2P2O7 | 立方晶系[16] | Pa3 | 865 | 865 | 865 | |||||
| Pa(C8H8)2 | 金黃 | 單斜晶系[17] | 709 | 875 | 1062 |
a,b和c是指每皮米的晶格常數,空間群編碼和Z是每單位晶格的數目;fcc表示面心立方對稱性。
同位素
目前已發現29個鏷的同位素,其中最穩定的是231Pa,半衰期為32760年,233Pa的半衰期為27天,230Pa的半衰期為17.4天。其它的大部分都小於1.6天,其中的大部分又小於1.8秒。鏷還有兩個核異構體:217mPa(半衰期 1.2毫秒)和234mPa(半衰期 1.17分)。[18]
鏷主要有兩種衰變模式:變成較輕原子的α衰變231Pa(212Pa 至 231Pa)以及變成較重原子的β衰變(232Pa 至 240Pa)。 同位素镤 231Pa主要的衰變產物為較輕的錒、較重的240Pa以及右的同位素。[18]
注意事項
镤既有毒性,又有很高的放射性,因此须在一個密封的手套箱进行操作。
其主要的同位素231鏷0.048居里/克,主要是發射α-粒子5 MeV,用薄的金屬即可阻擋。 然後它會慢慢的衰變(半衰期為32760年)成227Ac, 能量為 74 居里/g,進行α和β衰變,半衰期為22年。接著會衰變成半衰期更短、能量更大的元素 , 其結果整理於下表:
| 種類 | 231Pa | 227Ac | 227Th | 223Ra | 219Rn | 215Po | 211Pb | 211Bi | 207Tl |
|---|---|---|---|---|---|---|---|---|---|
| 放射劑量 (居里/克) | 0.048 | 73 | 3.1×104 | 5.2×104 | 1.3×1010 | 3×1013 | 2.5×107 | 4.2×108 | 1.9×108 |
| 衰變模式 | α | α, β | α | α | α | α | β | α, β | β |
| 半衰期 | 33 ka | 22 a | 19 days | 11 days | 4 s | 1.8 ms | 36 min | 2.1 min | 4.8 min |
镤是存在於自然界少量的天然元素,它是由食物或水攝入,或從空氣吸入。 會存在於中的只會有0.05%,其餘的會排出體外。其中的0.05%會進入骨骼, 有15%會進入肝臟,2% 進入腎臟,急於的再度離開身體。因此,在肝臟中的镤有70%的半衰期為10天,30%保持60天。腎臟的相應值分別為20%(10天)和80%(60天)。所有這些器官中,镤的放射性會促進腫瘤生成。[19] 在人體內的231Pa最大安全劑量是0.03 微居里,相當於0.5微克,這種同位素是氫氰酸毒性的2.5 × 108倍。[20] 231Pa 在空氣中的最大存在量為 3×10-4 Bq/m3.[19]
參考文獻
- Donohue, J. . Acta Crystallographica. 1959, 12 (9): 697. doi:10.1107/S0365110X59002031.
- Magnetic susceptibility of the elements and inorganic compounds 的存檔,存档日期2012-01-12., in Handbook of Chemistry and Physics 81st edition, CRC press.
- 异体字字典
- Emsley, John. . . Oxford, England, UK: Oxford University Press. 2003: 347–349 [2001]. ISBN 0-19-850340-7.
- Laing, Michael. . Foundations of Chemistry. 2005, 7 (3): 203. doi:10.1007/s10698-004-5959-9.
- National Research Council (U.S.). Conference on Glossary of Terms in Nuclear Science and Technology. . American Society of Mechanical Engineers. 1957: 180 [25 July 2015].
- Crookes, W. . Proceedings of the Royal Society of London. 1899, 66: 409–423. doi:10.1098/rspl.1899.0120.
- Hammond, C. R. 81st. CRC press. ISBN 0-8493-0485-7.
- Myasoedov, B. F.; Kirby, H. W.; Tananaev, I. G. . Morss, L. R.; Edelstein, N. M.; Fuger, J. (编). 3rd. Dordrecht, The Netherlands: Springer. 2006. ISBN 978-1-4020-3555-5.
- . [2013-03-21]. (原始内容存档于2011年9月28日). 橡树岭国家实验室.
- Sellers, Philip A.; Fried, Sherman; Elson, Robert E.; Zachariasen, W. H. . Journal of the American Chemical Society. 1954, 76 (23): 5935. doi:10.1021/ja01652a011.
- Brown D., Hall T.L., Moseley P.T. . J. Chem. Soc., Dalton Trans. 1973, (6): 686–691. doi:10.1039/DT9730000686.
- Tahri, Y; Chermette, H; Elkhatib, N; Krupa, J; Simoni, E. . Journal of the Less Common Metals. 1990, 158: 105. doi:10.1016/0022-5088(90)90436-N.
- Dodge, R. P.; Smith, G. S.; Johnson, Q.; Elson, R. E. . Acta Cryst. 1967, 22: 85–89. doi:10.1107/S0365110X67000155.
- Brown, D.; Petcher, T. J.; Smith, A. J. . Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 1969, 25 (2): 178. doi:10.1107/S0567740869007357.
- Brandel, V.; Dacheux, N. . Journal of Solid State Chemistry. 2004, 177 (12): 4743. Bibcode:2004JSSCh.177.4743B. doi:10.1016/j.jssc.2004.08.009.
- Starks, David F.; Parsons, Thomas C.; Streitwieser, Andrew.; Edelstein, Norman. . Inorganic Chemistry. 1974, 13 (6): 1307. doi:10.1021/ic50136a011.
- Audi, G. (PDF). Nuclear Physics A. 2003, 729: 3. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001. (原始内容 (PDF)存档于2008-09-23).
- Grossmann, R; Maier, H; Szerypo, J; Friebel, H. . Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 2008, 590: 122. Bibcode:2008NIMPA.590..122G. doi:10.1016/j.nima.2008.02.084.
- Palshin, E.S.; 等. . Moscow: Nauka. 1968.
外部連結
- 元素镤在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— {{LinkForElement|Pa| }}(英文)
- 元素镤在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素镤在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – {{LinkForElement|Pa| }}(英文)