钨
鎢(IUPAC名:tungsten[3] ),化學符號:W(德語:Wolfram [4][5]),是化學元素,原子序數是74,是非常硬、鋼灰色至白色的過渡金屬。元素名字Tungsten是來自瑞典古文的白鎢礦,tung sten,意旨重石[6]。鎢是卑金屬,在自然界大多與其他元素以化合物的形態存在,而不是單獨存在。鎢在西元1781年被發現且命名,在1783年第一次成功分離出鎢。黑鎢礦以及白鎢礦是鎢的重要礦石。
| 外觀 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
灰白色,有光澤 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 鎢(Tungsten)·W·74 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 過渡金屬 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·週期·區 | 6 ·6·d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 183.84 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | [Xe] 4f14 5d4 6s2[1] 2, 8, 18, 32, 12, 2 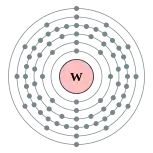 鎢的电子層(2, 8, 18, 32, 12, 2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 發現 | 托尔贝恩·伯格曼(1781年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分離 | Juan José Elhuyar和Fausto Elhuyar(1783年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 固體 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 19.25 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點時液體密度 | 17.6 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | 3695 K,3422 °C,6192 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 5933 K,5660 °C,10220 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | 35.3 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | 806.7 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | 24.27 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸氣壓
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | 6, 5, 4, 3, 2, 1, 0, −1, −2 (微酸性氧化物) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | 2.36(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:770 kJ·mol−1 第二:1700 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半徑 | 139 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | 162±7 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 體心立方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 順磁性[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電阻率 | (20 °C)52.8 n Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 173 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨脹係數 | (25 °C)4.5 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 楊氏模量 | 411 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 161 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 體積模量 | 310 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 7.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 維氏硬度 | 3430 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 2570 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 7440-33-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:鎢的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
鎢元素的穩定性是非常出色的,在所有元素中擁有第二高的熔點3422 °C(6192 °F, 3695 K)以及最高的沸點5660 °C (10706 °F, 6203 K)[7]。密度為19.25 g·cm−3,與鈾與金的密度相當,比鉛的密度還高1.7倍[8]。多晶鎢本身堅硬易脆[9][10](在標準條件下,未與其他物質結合時),難以進行加工使用。然而,若是純單晶鎢,則具有延展性,可使用鋼鋸切割[11]。
鎢合金有許多的應用,包含燈泡燈絲、X射線管、鎢極氣體保護電弧焊、超合金和輻射防護屏蔽。鎢的高硬度和高密度的特性,可用於軍事用途上,如穿甲彈。鎢化合物也經常在工業上作為催化劑使用。 鎢是第三過渡族中唯一一個其存在於一些少數細菌與古細菌中的金屬。是任何生物體內不可或缺元素中最重的一個元素[12]。然而,鎢會干擾鉬和銅的代謝[13][14],對於一般常看到的生物體是具有一些毒性的。
字源
瑞典化學家最早由白鎢礦中分離出鎢酸,因此根據白鎢礦這種礦石的瑞典古名,將這種元素以瑞典語:(這個字可被分解為,字面意義為重石)命名。在英文、法文等語言中,都使用這個名稱(除了北歐五國)。但因為在瑞典文中也是白鎢礦的名稱,為了避免混淆,瑞典採用作為元素的名稱。
在歐洲其他國家,主要以德文及各斯拉夫語為代表,則使用德語:或,在北歐五國也使用這個名稱。這個名稱來自黑钨矿(Wolframite)這個礦石的名字[15]。符号“W”及中文“钨”的来源都来自德文Wolfram。
黑鎢礦(Wolframite)的名字來自德文 "wolf rahm" ("wolf soot"狼煤煙 或 "wolf cream"狼奶油),於1747年由約翰‧嘎爾修特‧瓦萊裡烏斯給定。這來自於拉丁文 "lupi spuma",為格奧爾格·阿格里科拉在1546年對這個元素的稱呼,英文翻譯為「狼的白沫」,指的是這個礦物在萃取的過程消耗大量的錫。
主要特征
物理性質
純鎢是鋼灰色至錫白色的堅硬金屬,通常很脆而不易金屬加工,非常純的鎢可以維持它的硬度(高於許多其他金屬),且具有延展性,易於加工。鎢的加工方法有鍛造、拉伸和衝擊。鎢常常以燒結的方法製成。
在所有純金屬中,鎢的熔點最高(3415℃,6192 °F)蒸汽壓最低,(溫度1650℃,3000 °F以上),強度最高[16]。雖然碳相較於鎢能在較高的溫度下維持固態,但是碳在氣壓下容易昇華而非熔化,因此,它不具有熔點。鎢擁有最低的熱膨脹係數。它的低熱膨脹係數、高熔點,以及高抗張強度,都源自于鎢原子間的強金屬鍵。少量的鎢與鋼合金,能夠大大提升它的硬度
鎢以兩種晶體慣態結構存在:α和β。前者以立方體心堆積,是較穩定的組成。後者則是亞穩定的A15 立方體堆積,但因為非平衡合成或雜質造成的穩定性,可以與周圍條件下的α相共存。相較于α相擁有等長的晶粒,β相展現圓柱狀的晶性。α相的電阻率只有β相的三分之一,且具有遠低於β相的超導轉移溫度(臨界點TC):ca. 0.015 K vs. 1–4 K;混合兩者可以得到中間值得臨界溫度TC。以其他金屬與鎢合金也可以提高它的臨界溫度TC,此類鎢合金可以用於低溫超導電路。
同位素
天然鎢由四種穩定同位素(182W、183W、184W 以及 186W)以及一種長壽命的放射性同位素(180W)組成 [180W的半衰期非常長,可以看作是穩定同位素]。理論上,這五種同位素都能夠藉由α衰變成元素72(鉿),但只有180W觀測到此種現象(半衰期:(1.8±0.2)×1018年)。平均來說,每年每克的180W進行兩次α衰變[17],其他同位素尚未被觀察到天然衰變,因此它們的半衰期至少4 × 1021年。
目前有另外30種鎢的人造放射性同位素被確立,其中最穩定是半衰期121.2天的181W、75.1天的185W、69.4天的188W、21.6天的178W以及23.72小時的187W[17]。剩下所有的放射性同位素,半衰期都不超過三小時,其中大部份的更少於八分鐘[17]。鎢也有11種變異,最穩定的是179mW(t1/2 6.4 分鐘)。
化學性質
鎢最常見的氧化態是+6價,但它也有-2至+6之間的氧化狀態。最常見的氧化物是黃色的三氧化鎢, WO3,它可以在鹼性的水中溶化形成WO2−
4
碳與粉狀鎢加熱可以製成鎢的碳化物(W2C和WC),W
2C通常不易發生化學反應,但容易和氯產生六氯化鎢(WCl6)。
在中性或酸性水溶液中,鎢可以形成異性聚合酸以及多原子離子酸,隨著鎢酸鹽與酸作用,先形成可溶的亞穩定”仲鎢酸A”陰離子W
7O6–
24,接著轉變成溶解度較低的”仲鎢酸B“陰離子 H
2W
12O10–
42[18],最後穩定態達成,更酸化成易溶的的偏鎢酸根陰離子H
2W
12O6–
40。偏鎢酸根離子以對稱的十二鎢酸八面體存在(Keggin structure)。許多其他的多原子離子酸以亞穩定種類存在,包括以磷取代偏鎢酸根中心的兩個氫原子,製成多變的異性聚合酸,例如磷鎢酸。
三氧化鎢可以與鹼金屬形成嵌入intercalation化合物,被稱作青銅,例如鈉鎢青銅 。
应用
钨的应用非常广泛,最常见的是碳化钨(WC)硬质合金。这样的硬质合金用在金属加工、采矿、采油和建筑工业中作为耐用金属。此外在电灯泡和真空管中钨丝的应用也很广。钨还常用作电极。钨可以拉成很细的丝,而且熔点非常高。它的其它应用包括:
- 由于钨的熔点非常高,所以常用於航空和高温環境,例如电子、加热和焊接(E.G. 钨极气体保护电弧焊)。
- 钨非常坚硬,非常紧密,因此制作重金属合金非常理想,这样的合金用在装甲、散热片和高密度的应用上例如压重物、平衡重物、船和飞机的压重物等。
- 由于钨非常紧密,飞镖往往含80%至97%的钨。
- 高速钢含钨,有时含18%的钨。
- 制造涡轮机片、耐用部分和保护层的高温合金含钨(哈氏合金、钨铬钴合金等)。
- 在子弹中使用钨来取代铅。
- 钨的化合物被用作催化剂、无机颜色。二硫化钨是高温润滑剂,它在500 °C依然稳定。
- 由于钨的漲性和硅酸硼玻璃类似,所以人們用它進行玻璃/金属密封
- 钨与镍、铁和钴的合金被用来制作重合金,这样的重合金用在动能弹中取代贫铀。
- 在集成电路中钨是前路之间的连接物。在二氧化硅绝缘体中侵蚀接触孔,注入钨,磨平来连接三极管。典型的接触孔可以小到65纳米。
- 碳化钨是最硬的物质之一,被用在机器工具和磨料中。碳化钨是磨具和转具中最常见的材料,往往也是最好的材料。
- 在放射医学中钨是屏蔽物质。运输氟脱氧葡萄糖一般用钨容器,因為氟脱氧葡萄糖中的高能量氟-18令铅容器无法使用。
其它:氧化钨被用在陶瓷釉中,钙或镁钨常用在荧光粉中。在核物理和核医学中钨晶体被用作闪烁探测器。钨被用作X射线目标和在电子炉中作为加热器。含钨的盐被用在化学和皮革工业中。青铜色的氧化钨被用在绘画中。由于它的低敏感性碳化钨被用作首饰,此外由于它非常硬它不会像其它擦光的金属被划痕。有些乐器的铉使用钨丝。
历史
1781年,瑞典化學家卡尔·威廉·舍勒發現,使用白钨矿,可以制作出一种新的酸,即钨酸。當時卡尔·威廉·舍勒與其友人托尔贝恩·贝里曼皆相信在鎢酸中一定可以進一步分解出一種新的化學元素。1783年胡塞·德盧亞爾和浮士圖·德盧亞爾兄弟发现从黑钨矿可以获得同样的酸。同年他们使用木炭还原钨酸获得了钨,因此他们被公认为钨的发现者[他們稱之為"wolfram" 或 "volfram"][19][20]。
鎢的戰略價值在二十世紀早期受到注意。英國當局在1912年把卡羅克礦坑(Carrock mine)從德國擁有的坎布里亞礦業公司解放出來,還有在一次世界大戰期間限制德國其他的取得來源。在二次世界大戰,鎢在政治交涉上扮演更加重要的角色。鎢在歐洲的主要來源是葡萄牙,當時受到雙方的壓力,因為在帕納什凱拉沉積的鎢礦。鎢抗高溫的特性,其硬度和密度,以及強化合金的功效讓它成為軍工業的重要材料,用作武器和設備的成分與製作過程(例如碳化鎢切割工具用於機械加工鋼鐵)。
来源
黑钨矿、白钨矿、钨铁矿等矿物含钨。重要的钨矿位于玻利维亚、美国加利福尼亚州和科羅拉多州、加拿大、中国、越南、葡萄牙、俄罗斯以及韩国。中国出产全世界钨的75%。通过使用碳还原钨的氧化物获得纯的金属。
全世界钨的贮藏总量估计为700万吨,其中约30%是黑钨矿,70%是白钨矿。但是目前大多数这些矿藏无法经济性地开采。按照目前的消耗量这些矿藏只够使用约140年。另一个获得钨的方法是回收。回收的钨比钨矿含量高,事实上利潤很高。
2017年中國、越南與俄羅斯分別供應了79,000、7,200、3,100吨。加拿大在2015年底停止生產因為其唯一的鎢礦礦坑關閉。越南在2010年左右因為其精煉工程的重大優化,大幅增加其產出,產量超過俄羅斯和玻利維亞。
中國仍然不只是全世界鎢製品最大的製造者,也是最大的出口和消費者。鎢的製造在中國外因需求上升而逐漸增加。同時中國的供給受到中國政府的嚴格管制,來對抗非法採礦和過多來自採礦與精煉過程的污染。
在英國達特穆爾的邊緣有大量的鎢礦沉積,在一次和二次世界大戰期間有利用。隨著鎢的價格上升,這個礦坑在2014年重新開張,但在2018年關閉。
同位素
自然界里出现的有五种钨的同位素,其中182W、183W、184W、186W是稳定同位素,180W的半衰期非常长,可以被看作是稳定同位素。所有这些同位素理论上均可以通过α衰变蜕化为铪,但是至今为止只有180W能够被观测到自然衰变,其半衰期为1.8×1018年,其它同位素没有被观测到自然衰变,估计的半衰期下界:182W, T1/2 > 1.7×1020 年,183W, T1/2 > 8×1019 年, 184W, T1/2 > 1.8×1020 年, 186W, T1/2 > 4.1×1018 年[22]。平均每年在一克180W中发生两次α衰变。
钨目前有27种人造放射性同位素,其中最稳定的是181W,其半衰期为121.2天,185W的半衰期为75.1天,188W的半衰期为69.4天,178W的半衰期为21.6天。其它放射性同位素的半衰期均在24小时以下,其中大多数少于8分钟。
参考文献
- . [2008-06-15].
- Magnetic susceptibility of the elements and inorganic compounds 的存檔,存档日期2011-03-03., in Handbook of Chemistry and Physics 81st edition, CRC press.
- PubChem Open Chemistry Database, , 美国国家生物技术信息中心, 1995 [May 15, 2015], (原始内容存档于May 19, 2015)
- wolfram on Merriam-Webster.
- wolfram on Oxford Dictionaries.
- . 牛津英語詞典 (第三版). 牛津大學出版社. 2005-09 (英语).
- Zhang Y; Evans JRG and Zhang S. . J. Chem. Eng. Data. 2011, 56 (2): 328–337. doi:10.1021/je1011086.
- Daintith, John. 4th. New York: Checkmark Books. 2005. ISBN 978-0-8160-5649-1.
- Lassner, Erik; Schubert, Wolf-Dieter. . . Springer. 1999: 20–21. ISBN 978-0-306-45053-2.
- Gludovatz, B.; Wurster, S.; Weingärtner, T.; Hoffmann, A.; Pippan, R. . Philosophical Magazine (Submitted manuscript). 2011, 91 (22): 3006–3020. Bibcode:2011PMag...91.3006G. doi:10.1080/14786435.2011.558861.
- Stwertka, Albert. 2nd. New York: Oxford University Press. 2002. ISBN 978-0-19-515026-1.
- Koribanics, N. M.; Tuorto, S. J.; Lopez-Chiaffarelli, N.; McGuinness, L. R.; Häggblom, M. M.; Williams, K. H.; Long, P. E.; Kerkhof, L. J. . PLoS ONE. 2015, 10 (4): e0123378. PMC 4395306. PMID 25874721. doi:10.1371/journal.pone.0123378.
- McMaster, J. & Enemark, John H. . Current Opinion in Chemical Biology. 1998, 2 (2): 201–207. PMID 9667924. doi:10.1016/S1367-5931(98)80061-6.
- Hille, Russ. . Trends in Biochemical Sciences. 2002, 27 (7): 360–367. PMID 12114025. doi:10.1016/S0968-0004(02)02107-2.
- van der Krogt, Peter. . Elementymology & Elements Multidict. [2010-03-11].
- Hammond, C. R. 81st. CRC press. 2004. ISBN 978-0-8493-0485-9.
- Sonzogni, Alejandro. . National Nuclear Data Center: Brookhaven National Laboratory. [2008-06-06]. (原始内容存档于2008-05-22).
- Smith, Bradley J.; Patrick, Vincent A. . Australian Journal of Chemistry. 2000, 53 (12): 965. doi:10.1071/CH00140.
- (PDF). [2008-01-27]. (原始内容 (PDF)存档于2008-03-07).
- (PDF). [2008-01-27]. (原始内容 (PDF)存档于2008-03-07).
- Emsley, John. 3rd edition. 2000.
- National Nuclear Data Center table of nuclides, http://www.nndc.bnl.gov/chart/
外部連結
- 元素钨在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— {{LinkForElement|W| }}(英文)
- 元素钨在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素钨在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – {{LinkForElement|W| }}(英文)
