铕
銪(Europium)是一種化學元素,符號為Eu,原子序為63。元素以歐洲(Europe)命名。銪是一種較堅硬的銀白色金屬,在空氣和水中容易氧化。它屬於典型的鑭系元素,氧化態通常為+3,但其+2態也並不鮮見。所有氧化態為+2的銪化合物都具有輕微的還原性。銪在生物體中沒有重要的功用,和其他重金屬相比毒性較低。銪的大部份應用都採用了其化合物的磷光特性,例如電視機的磷光體以及歐羅(欧元)紙幣的防偽磷光體等。
性質
物理性質


銪是一種可延展金屬,硬度與鉛相約。其晶體結構為體心立方。[2]銪的一些性質和其半滿的電子層有很大的關係。在鑭系元素中,銪的熔點第二低,密度則最低。[2]
在冷卻至1.8 K、加壓至80 GPa時,銪會變成超導體。這是因為,銪在金屬態下化合價為二,[3]在受壓的情況下化合價變為三。二價狀態下強大的局域磁矩(J = 7/2)抑制了超導相態,而三價時的磁矩為零,因此超導性質得以發揮。[4]
化學性質
銪是反應性最高的稀土元素。它在空氣中會迅速氧化:大約厘米大小的銪金屬樣本在幾天之內就會整塊氧化。[5]在水中銪的反應性和鈣相近,反應式為
- 2 Eu + 6 H2O → 2 Eu(OH)3 + 3 H2
由於反應性高,就算塗上一層礦物油保護層,固體銪樣本也一般不會有閃亮的金屬表面。銪會在150至180 °C的空氣當中自燃,形成三氧化二銪:
- 4 Eu + 3 O2 → 2 Eu2O3
銪在稀硫酸中容易溶解,形成淡粉紅色的水合銪(III)溶液:[6]
- 2 Eu + 3 H2SO4 + 18 H2O → 2 [Eu(H2O)9]3+ + 3 SO2−
4 + 3 H2
二價和三價銪
銪一般顯三價態,但有時也會形成二價化合物。這在幾乎完全形成三價化合物的鑭系元素中是比較少見的。銪的+2態的電子排布為4f7,因為半滿的f殼層有更高的穩定性。在大小和配位數方面,銪(II)和鋇(II)相似。例如,兩者的硫酸鹽都很難溶於水。[7]二價銪是一種弱還原劑,且會在空氣中氧化成三價銪化合物。在缺氧條件(特別是地熱條件)下,二價銪足夠穩定,所以會摻入鈣以及其他鹼土金屬的礦物之中。這種離子交換過程是「負銪異常」現象的基礎,即鑭系元素礦物(如獨居石)的銪含量相對顆粒隕石含量偏少。氟碳鈰礦(Bastnäsite)的負銪異常比獨居石輕微,因此成為了今天銪元素的主要來源。雖然銪的濃度一般很低,但由於它的二價離子可以很容易從其他三價鑭系元素中分離出來,所以較易取得。
同位素
自然形成的銪元素由兩種同位素組成:151Eu和153Eu,後者的豐度為52.2%,比前者稍高。153Eu是穩定同位素,但151Eu則會進行α衰變,半衰期為5+11
−3×1018 年,[8]即在1公斤自然銪樣本中大約每2分鐘發生一次α衰變事件。這一數值與理論預測值吻合。除了自然的放射性同位素151Eu以外,已知的人造放射性同位素共有35種,其中最穩定的有150Eu(半衰期為36.9年)、152Eu(13.516年)和154Eu(8.593年)。所有剩餘的放射性同位素半衰期都在4.7612年以下,且大部份小於12.2秒。銪共有8種亞穩態,最穩定的有150mEu(半衰期為12.8小時)、152m1Eu(9.3116小時)和152m2Eu(96分鐘)。[9]
質量比153Eu低的同位素衰變模式主要是電子捕獲,並一般產生釤的同位素;質量更高的則主要進行β−衰變,並一般產生釓的同位素。[9]
作為核裂變產物
| 同位素 | 151Eu | 152Eu | 153Eu | 154Eu | 155Eu |
|---|---|---|---|---|---|
| 產量 | ~10 | 低 | 1580 | >2.5 | 330 |
| 靶恩 | 5900 | 12800 | 312 | 1340 | 3950 |
銪是某些核裂變反應的產物,但銪同位素質量較高,其裂變產物產量很低。
和其他鑭系元素一樣,銪的許多同位素,特別是奇數質量數和低中子數的同位素(如152Eu),擁有很高的中子捕獲截面,通常可以作為中子毒物。
釤-151經β衰變後會產生151Eu,但由於半衰期長,吸收中子的平均時間短,所以大部份151Sm最終會變為152Sm。
| 项: 单位: | t½ a | 产额 % | Q* KeV | βγ * |
|---|---|---|---|---|
| 155Eu | 4.76 | .0803 | 252 | βγ |
| 85Kr | 10.76 | .2180 | 687 | βγ |
| 113mCd | 14.1 | .0008 | 316 | β |
| 90Sr | 28.9 | 4.505 | 2826 | β |
| 137Cs | 30.23 | 6.337 | 1176 | βγ |
| 121mSn | 43.9 | .00005 | 390 | βγ |
| 151Sm | 90 | .5314 | 77 | β |
152Eu(半衰期為13.516年)和154Eu(8.593年)不能作為β衰變產物,因為152Sm和154Sm都沒有放射性。154Eu和134Cs是僅有的兩個裂變產量高於百萬分之2.5的長壽命受屏蔽核素。[10]對153Eu進行中子活化,可以產生更大量的154Eu,但其中大部份會再轉化為155Eu。
對於鈾-235和熱中子,155Eu(半衰期為4.7612年)的裂變產量為百萬分之330,其大部份會在燃料燃耗結束時嬗變成無放射性、無吸收性的釓-156。
整體來說,在輻射危害上,銪比銫-137和鍶-90弱得多,而作為中子毒物,銪則比釤弱很多。[11][12][13][14][15][16][17]
存量

銪在自然界中不以單體出現。許多礦物都含有銪,其中最重要的包括:氟碳鈰礦、獨居石、磷釔礦和鈰鈮鈣鈦礦。[18]
相對其他稀土元素來說,銪有時會在礦物中具有偏高或者偏低的含量,這種現象稱為銪異常。[19]地球化學和岩石學的微量元素分析常用到銪元素,以了解火成岩的形成過程。通過分析銪異常情況,可有助重建一套火成岩之間的關係。
少量的二價銪(Eu2+)可以作為某些螢石(CaF2)樣本的亮藍色螢光激活劑。Eu3+在高能粒子照射下會變為Eu2+。[20]這種螢光礦物可以在英國北部Weardale及周邊地區。英文中的螢光一詞(fluorescence)就是來自此處所發現的螢石(fluorite)。直到很久以後人們才發現,螢光是礦石中的銪所造成的。[21][22][23][24]
生產
銪一般和其他的稀土元素一同出現,所以是一起開採,並之後再分離開來的。氟碳鈰礦、鈰鈮鈣鈦礦、磷釔礦和獨居石等礦石中含有可開採量的稀土元素。首兩種為正磷酸鹽礦物LnPO4(Ln表示除鉕以外所有的鑭系元素),磷釔礦為氟碳酸鹽礦物LnCO3F。獨居石同時含有釷和釔,而釷及其衰變產物都具有放射性,使處理過程更為困難。從原礦萃取和分離各種鑭系元素的方法有幾種。方法的選擇要考慮礦物的成份和濃度,以及每種鑭系元素在礦物濃縮物中的分佈。礦石首先經過烘烤,再經酸鹼來回浸溶,形成鑭系元素的混合濃縮物。如果其中鈰居多,就可將鈰(III)轉化為鈰(IV),從而沉澱出來。利用溶劑萃取法或離子交換層析法能夠增加銪在混合物中的比例。用鋅、鋅汞齊、電離等方法可以把銪(III)轉化為銪(II)。後者的化學性質和鹼土金屬相似,因此可以以碳酸鹽的形態沉澱出來,或與硫酸鋇共沉澱。[25]要製備銪金屬,可以對熔融三氯化銪(EuCl3)和氯化鈉(NaCl)或氯化鈣(CaCl2)的混合物進行電離,以石墨電解槽作為陰極,石墨作為陽極。反應同時也會產生氯氣。[18][25][26][27][28]
世界上有多個出產銪的大型礦藏。中國內蒙古的白雲鄂博鐵礦含有大量的氟碳鈰礦和獨居石,估計稀土金屬氧化物的含量有3600萬噸,因此它是目前世界上最大的礦藏。[29][30][31]中國依靠白雲鄂博鐵礦在1990年代成為了最大的稀土元素產國。所產出的稀土元素中,只有0.2%是銪。1965年至1990年代,美國加州山口(Mountain Pass)稀土礦場是全球第二大稀土元素來源。當地的氟碳鈰礦含有較高濃度的輕稀土元素(鑭至釓、鈧、釔),而銪含量則只有0.1%。俄羅斯西北部的科拉半島出產鈰鈮鈣鈦礦,是另一個大型稀土元素產地。除鈮、鉭和鈦以外,它擁有高達30%的稀土元素,因此是這些元素在俄羅斯的最大來源。[18][32]
化合物

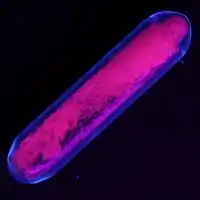
2_(UV).gif)
在大多數條件下,銪化合物都具有+3氧化態。在這些化合物中,銪(III)通常與6至9個含氧配位體(通常為水)成鍵。銪的氯化物、硫酸鹽、硝酸鹽都可溶於水和極性有機溶液。具親脂性的銪配合物一般擁有類似乙酰丙酮的配位體,例如EuFOD。
研究歷史
雖然銪存在於大部份稀有元素礦物之中,但由於分離過程的困難,所以直到19世紀末該元素才被分離出來。威廉·克魯克斯在1885年對稀有元素的螢光光譜進行過分析,其中的一些「異常」譜線後來發現來自於銪元素。[34]
保羅·埃米爾·勒科克·德布瓦博德蘭於1890年首次發現銪元素。他在釤釓濃縮物的分餾提取物中,觀測到了既不屬於釤,又不屬於釓的譜線。然而,一般的說法是法國化學家尤金·德馬塞發現了銪。他在1896年懷疑新發現的釤樣本中有一種未知元素的污染物,並在1901年成功將其分離出來。他依據歐洲的名稱「Europe」將此元素命名為「Europium」。[35][36]
1960年代初,人們發現了摻銪正釩酸釔紅色磷光體。但在彩色電視機工業即將革新之時,獨居石加工廠卻無法維持足夠的銪元素供給,[37]因為獨居石的銪含量一般只在0.05%左右。當時莫利礦業位於加州山口的氟碳鈰礦藏即將開啟運作,當地的稀土礦含有異常高的0.1%銪含量,所以能夠支撐這一工業。在銪磷光體被發現之前,彩色電視機的紅色磷光體很弱,以致其他顏色的磷光體須要抑制才能保持顏色的平衡。銪磷光體能產生明亮的紅光,因此不再須要調低別的顏色,彩色電視機的亮度也可以大大提高。[37]自此銪就一直用於電視機和電腦螢屏的生產中。加州山口稀土礦場之後面臨中國白雲鄂博鐵礦的競爭,後者能產出銪含量為0.2%的礦石。
弗蘭克·斯佩丁(Frank Spedding)對發展離子交換技術所作出的貢獻在1950年代中革新了稀土工業。他曾自述[38]在1930年代在做有關稀土元素的演講時,一位老人說要向他獻上幾磅重的氧化銪。當時這算作是極大量的銪,所以斯佩丁並沒有認真對待。但不久後他確實收到了內含幾磅氧化銪的郵件。這位老人正是發展了氧化還原銪純化方法的赫伯特·紐比·麥科伊(Herbert Newby McCoy)。[27][39]
應用

銪的商業用途非常有限。幾乎所有應用都用到銪在+2或+3氧化態下的磷光特性。
在激光器和其他光電裝置中,銪可以作玻璃的摻雜劑。三氧化二銪是一種常用的紅色磷光體,用於CRT電視機和螢光燈中。它也是釔基磷光體的激活劑。[40][41]彩色電視機屏含有0.5至1克銪元素。[42]三價銪磷光體能給出紅光,但二價銪的螢光顏色則取決於主體晶格,一般靠近藍色。兩種銪磷光體(紅、藍)加上黃綠色的鋱磷光體,可產生「白」光。通過調節不同磷光體的比例,可以產生不同色溫的白光。這種螢光系統一般應用在螺旋型螢光燈泡中。一些電視機和電腦螢屏也同樣使用這種系統作為其三個原色。[40]螢光玻璃的生產也用到了銪。除摻銅硫化鋅之外,另一種持續發光的較常見磷光體就是摻銪氯酸鍶。[43]銪的螢光性質還能用在新葯研發篩選過程中,以追蹤生物分子的相互作用。歐羅紙幣的防偽磷光體也含有銪。[44][45]
銪配合物,如Eu(fod)3,可以用作核磁共振光譜法的位移試劑,但這項應用已近乎被平價超導磁鐵所淘汰。手性位移試劑(如Eu(hfc)3)今天仍被用於測量對映異構體純度。[46][47][48][49][50]
安全
沒有明確證據顯示銪的毒性比其他的重金屬高。氯化銪的急性腹腔注射半數致死量(LD50)為550 mg/kg,急性口服LD50為5000 mg/kg。硝酸銪的腹腔注射LD50為320 mg/kg,口服LD50超過5000 mg/kg。[51][52]
粉狀的銪金屬有自燃或爆炸的危險。[53]
參考資料
- Magnetic susceptibility of the elements and inorganic compounds 的存檔,存档日期2011-03-03., in Lide, D. R. (编), 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 978-0-12-352651-9.
- Johansson, Börje; Rosengren, Anders. . Physical Review B. 1975, 11 (8): 2836–2857. Bibcode:1975PhRvB..11.2836J. doi:10.1103/PhysRevB.11.2836.
- Debessai, M.; Matsuoka, T.; Hamlin, J.; Schilling, J.; Shimizu, K. . Phys. Rev. Lett. 2009, 102 (19): 197002. Bibcode:2009PhRvL.102s7002D. PMID 19518988. doi:10.1103/PhysRevLett.102.197002.
- . [2009-08-08]. (原始内容存档于2019-01-30).
- . Webelements. [2009-06-06]. (原始内容存档于2009-05-01).
- Cooley, Robert A.; Yost, Don M.; Stone, Hosmer W. . Inorganic Syntheses 2: 69–73. 1946. ISBN 978-0-470-13233-3. doi:10.1002/9780470132333.ch19.
|chapter=被忽略 (帮助) - Belli, P.; 等. . Nuclear Physics A. 2007, 789: 15–29. Bibcode:2007NuPhA.789...15B. doi:10.1016/j.nuclphysa.2007.03.001.
- Nucleonica. . Nucleonica: Universal Nuclide Chart. Nucleonica. 2007–2011 [2011-07-22]. (原始内容存档于2017-02-19).
- Tables of Nuclear Data 页面存档备份,存于, Japan Atomic Energy Agency
- Oh, S.Y.; Chang, J.; Mughabghab, S. . 2000. doi:10.2172/759039.
- Inghram, Mark; Hayden, Richard; Hess, David. . Physical Review. 1947, 71 (9): 643–643. Bibcode:1947PhRv...71..643I. doi:10.1103/PhysRev.71.643.
- Hayden, Richard; Reynolds, John; Inghram, Mark. . Physical Review. 1949, 75 (10): 1500–1507. Bibcode:1949PhRv...75.1500H. doi:10.1103/PhysRev.75.1500.
- Meinke, W. W.; Anderson, R. E. . Analytical Chemistry. 1954, 26 (5): 907–909. doi:10.1021/ac60089a030.
- Farrar, H; Tomlinson, R.H. . Nuclear Physics. 1962, 34 (2): 367–381. Bibcode:1962NucPh..34..367F. doi:10.1016/0029-5582(62)90227-4.
- Inghram, Mark; Hayden, Richard; Hess, David. . Physical Review. 1950, 79 (2): 271–274. Bibcode:1950PhRv...79..271I. doi:10.1103/PhysRev.79.271.
- Fajans, Kasimir; Voigt, Adolf. . Physical Review. 1941, 60 (7): 533–534. Bibcode:1941PhRv...60..533F. doi:10.1103/PhysRev.60.533.2.
- Maestro, Patrick. . 14. : 1096–1120. ISBN 978-0-471-23896-6. doi:10.1002/0471238961.120114201901021.
- Sinha, Shyama P.; Scientific Affairs Division, North Atlantic Treaty Organization. . . 1983: 550–553 [2014-06-04]. ISBN 978-90-277-1613-2. (原始内容存档于2014-07-09).
- Bill, H.; Calas, G. . Physics and Chemistry of Minerals. 1978, 3 (2): 117–131. Bibcode:1978PCM.....3..117B. doi:10.1007/BF00308116.
- Valeur, Bernard; Berberan-Santos, Mário N. . Journal of Chemical Education. 2011, 88 (6): 731–738. Bibcode:2011JChEd..88..731V. doi:10.1021/ed100182h.
- Mariano, A; King, P. . Geochimica et Cosmochimica Acta. 1975, 39 (5): 649–660. Bibcode:1975GeCoA..39..649M. doi:10.1016/0016-7037(75)90008-3.
- Sidike, Aierken; Kusachi, I.; Yamashita, N. . Physics and Chemistry of Minerals. 2003, 30 (8): 478–485. Bibcode:2003PCM....30..478S. doi:10.1007/s00269-003-0341-3.
- Przibram, K. . Nature. 1935, 135 (3403): 100–100. Bibcode:1935Natur.135..100P. doi:10.1038/135100a0.
- Gupta, C. K.; Krishnamurthy, N. . International Materials Reviews. 1992, 37: 197–248 [2014-06-04]. (原始内容存档于2012-10-24).
- Morais, C; Ciminelli, V.S.T. . Hydrometallurgy. 2001, 60 (3): 247–253. doi:10.1016/S0304-386X(01)00156-6.
- McCoy, Herbert N. Journal of the American Chemical Society. 1936, 58 (9): 1577–1580. doi:10.1021/ja01300a020. 缺少或
|title=为空 (帮助) - Neikov, Oleg D.; Naboychenko, Stanislav; Gopienko, Victor G.; Frishberg, Irina V. . 2009-01-15: 505 [2014-06-04]. ISBN 978-1-85617-422-0. (原始内容存档于2014-07-09).
- Lawrence J. Drewa, Meng Qingrunb and Sun Weijun. . Lithos. 1990, 26 (1–2): 43–65. Bibcode:1990Litho..26...43D. doi:10.1016/0024-4937(90)90040-8.
- Xue-Ming Yang, Michael J. Le Bas. . Lithos. 2004, 72 (1–2): 97–116. Bibcode:2004Litho..72...97Y. doi:10.1016/j.lithos.2003.09.002.
- Chengyu Wu. . Resource Geology. 2007, 58 (4): 348 [2014-06-04]. doi:10.1111/j.1751-3928.2008.00069.x. (原始内容存档于2012-12-17).
- Hedrick, J; Sinha, S; Kosynkin, V. . Journal of Alloys and Compounds. 1997, 250: 467–470. doi:10.1016/S0925-8388(96)02824-1.
- Archer, R. D.; Mitchell, W. N.; Mazelsky, R. . Inorganic Syntheses 10: 77–79. 1967. ISBN 978-0-470-13241-8. doi:10.1002/9780470132418.ch15.
|chapter=被忽略 (帮助) - Crookes, W. . Proceedings of the Royal Society of London. 1905, 76 (511): 411–414. Bibcode:1905RSPSA..76..411C. JSTOR 92772. doi:10.1098/rspa.1905.0043.
- Demarçay, Eugène-Anatole. . Comptes rendus. 1901, 132: 1484–1486 [2014-06-04]. (原始内容存档于2013-12-24).
- Weeks, Mary Elvira. . Journal of Chemical Education. 1932, 9 (10): 1751. Bibcode:1932JChEd...9.1751W. doi:10.1021/ed009p1751.
- Srivastava, A. M.; Ronda, C. R. (PDF). The Electrochemical Society Interface. 2003: 48–51 [2014-06-04]. (原始内容存档 (PDF)于2014-06-30).
- Spedding, Frank H. . Discussions of the Faraday Society. 1949, 7: 214. doi:10.1039/DF9490700214.
- Corbett, John D. . Biographical Memoirs National Academy of Sciences (National Academy of Sciences). 1986, 80 (5): 106 [2020-09-20]. Bibcode:1986PhT....39e.106H. doi:10.1063/1.2815016. (原始内容存档于2012-04-05).
- Caro, Paul. . . 1998-06-01: 323–325 [2014-06-04]. ISBN 978-84-89784-33-8. (原始内容存档于2014-05-03).
- Bamfield, Peter. . . 2001: 159–171 [2014-06-04]. ISBN 978-0-85404-474-0. (原始内容存档于2014-05-03).
- Gupta, C. K.; Krishnamurthy, N. . International Materials Reviews. 1992, 37: 197–248 [2014-06-04]. (原始内容存档于2012-10-24).
- Lakshmanan, Arunachalam. . . 2008 [2014-06-04]. ISBN 978-1-60456-018-3. (原始内容存档于2014-07-06).
- . [2009-06-06]. (原始内容存档于2009-08-04).
- Cotton, Simon. . . 2006: 77 [2014-06-04]. ISBN 978-0-470-01006-8. (原始内容存档于2014-05-03).
- Richards, Stephen; Hollerton, John. . 2011-02-15 [2014-06-04]. ISBN 978-0-470-71092-0. (原始内容存档于2014-06-06).
- Pavia, Donald L; Lampman, Gary M. . 2009 [2014-06-04]. ISBN 978-0-495-11478-9. (原始内容存档于2014-06-07).
- Wenzel, Thomas J. . 2007 [2014-06-04]. ISBN 978-0-471-76352-9. (原始内容存档于2014-06-06).
- Cotton, Simon. . 2006 [2014-06-04]. ISBN 978-0-470-01006-8. (原始内容存档于2014-05-03).
- Gschneidner, Karl A; Bünzli, Jean-Claude; Pecharsky, Vitalij K. . 2005-09-26 [2014-06-04]. ISBN 978-0-444-52028-9. (原始内容存档于2014-06-07).
- Haley, Thomas J.; Komesu, N.; Colvin, G.; Koste, L.; Upham, H. C. . Journal of Pharmaceutical Sciences. 1965, 54 (4): 643–5. PMID 5842357. doi:10.1002/jps.2600540435.
- Bruce, D; Hietbrink, Bernard E.; Dubois, Kenneth P. . Toxicology and Applied Pharmacology. 1963, 5 (6): 750. doi:10.1016/0041-008X(63)90067-X.
- Lenntech BV. . Lenntech Periodic Table. Lenntech BV. [July 20, 2011]. (原始内容存档于2014-06-05).
外部連結
| 维基共享资源中相关的多媒体资源:铕 |
| 查询維基詞典中的。 |
- 元素铕在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— {{LinkForElement|europium| }}(英文)
- 元素铕在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素铕在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – {{LinkForElement|europium| }}(英文)