钍
所有已知釷的同位素皆不穏定,最穩定的同位素232Th的半衰期長達140億年,與宇宙年齡相當。它緩慢地經由α衰變開始名為釷系列的衰變鏈,最終止於穩定的208Pb。在宇宙中,釷、鉍及鈾是唯三存量尚高的原初放射性元素。[lower-alpha 1]估計在地殻中存量為鈾的三倍強,生產來源主要是獨居石砂中提取稀土元素的副產物。
業餘揶威礦物學家Morten Thrane Esmark在1829年發現了釷,瑞典化學家永斯·貝吉里斯在鑑定後,以北歐神話中的雷神索爾(Thor)命名。釷在十九世紀末開始應用,釷的放射性在1900年代被廣為認知。在二十世紀後半因擔憂釷的放射性,其許多用途皆被取代。
釷是鎢極氣體保護電弧焊中,電極裡的合金元素,但其使用逐漸被取代。釷也被應用在科學儀器中高階光學元件,也在煤氣網罩做為光源使用,但這些用量都很小。有人建議用釷取代鈾作為核反應爐的燃料,已有數個釷反應爈被建造。
整體性質
釷的硬度一般,具順磁性,為亮銀色放射錒系金屬元素。在週期表中,位於錒之右,鏷之左,鈰之下。純釷的延展性相當好, 與一般金屬一樣,可被冷軋、擠鍛及拉製。[3]。在室溫下,釷金屬為面心立方堆積,它有其它兩種形態,一個在高溫(超過1360 °C,體心立方堆積),一個在高壓(約100 GPa,體心四方堆積)。[3]
釷金屬的體積模數(一種物質有多難壓縮的度量)為54 GPa,與錫約同(58.2 GPa)。鋁為(75.2 GPa),銅為137.8 GPa,軟鋼(低碳鋼)則為160–169 GPa。.[4]釷的硬度與軟鋼差不多,所以加熱後可被滾成薄板及拉製成線。[5]
釷的密度約為鈾及鈽的一半,但硬度比二者高。[5]溫度比1.4 K低時會變成超導體。[3]釷的熔點為1750 °C,比錒(1227 °C)及鏷都來得高(1568 °C)。在第七週期前段,從鍅到釷,熔點逐漸上升(與其它週期相同),這是因為原子中的非定域電子數目從鍅的一顆增加到釷的四顆,這導致金屬的電荷從+1增加到+4,而電子與金屬離子的吸引力也因此上升。在釷之後直到鈽,熔點開始下降,f電子的數目也從0.4左右增加到6左右,這是因為5f軌域及6d軌域混成比例增加,在更複雜的晶體結構中形成了有方向的化學鍵而弱化了金屬鍵。[5][6](釷之中的f電子數目並非整數,因為5f及6d之間有重疊)[6]在錒系元素裡,在鉲之前並可在毫克等級下做分析的元素中,釷則具有最高的熔點沸點,以及第二低的密度,只有錒比釷輕。[lower-alpha 2]釷的沸點為4788 °C,在所有已知沸點的元素中是第五高。[lower-alpha 3]
釷的性質會因樣品中雜質含量的不同而有大幅變化,主要的雜質通常是二氧化釷(ThO2),即使是最純的釷樣品,通常也含有大約千分之一的氧化物。[3]實驗測量出的密度界於11.5及11.66 g/cm3之間,略小於理論預測值11.7 g/cm3,這也許是因為在製成金屬時形成了微觀空洞。[3]這些值位於隔鄰的錒(10.1 g/cm3)及鏷(15.4 g/cm3)之間,也符合錒系前段元素的趨勢。[3]
釷可與許多金屬形成合金。加入少量的釷可以增加鎂的機械強度,釷鋁合金被認為是一種在未來釷核反應爐來儲存釷的方法。釷與鉻及鈾形成共熔混合物,並與較輕的同族元素鈰在液態及固態都完全互溶。[3]
同位素
在鉍(83號元素)之前的元素,都有一種幾乎在任何應用下都穩定的同位素(古典穩定),但鎝及鉕(43號元素及61號元素)除外。所有從釙(84號元素)開始的元素,都有可測的放射性。232Th是在鉍之後,三種半衰期以億年計的核種之一(另兩個核種是235
U及238
U),釷的半衰期為140.5億年,為地球年齡的三倍,與宇宙的年齡相當。地球中的五分之四的釷留存至今。[9][10][11]232Th是唯一在自然中大量存在的釷同位素,[9]其穩定性與其閉核殼層中的142顆中子習習相關。[12][13]釷有特定的地球同位素比例,其原子量為232.0377(4)。在地球上有足夠量以確定標準原子量的放射性元素有四個,釷為其中之一(另三個為鉍、鏷及鈾)。[1]
釷原子核會因為強核作用力無法克服質子間的電磁排斥力,而發生α衰變。[14]232Th的α衰變是一4n衰變鏈的開端,此衰變鏈中核種的核子數皆可被4整除(這也是為什麼被取名為4n衰變鏈,這衰變鏈也因啟始物而被叫做釷系列)。這一系列的α及β衰變以232Th衰變至228Ra為始,止於208Pb。[9] 任何釷及其化合物的樣品,都含有這些後續核種的痕跡,包括了釷、鉈、鉛、鉍、釙、氡、鐳及錒的同位素。[9] 自然的釷樣品可用化學方式來提純有用的後續核種,像是可被用做核醫學中癌症治療的212Pb,227Th(會以18.68天的半衰期發射出α粒子)也可被用作α粒子標靶治療。[15][16][17]在非常偶然地的情況下,232Th會進行自發裂變而非α衰變,在其礦物中留下了此反應的證據(也就是受困其中的反應產物氙氣),但其部份半衰期長達1021年,所以α衰變佔絕大多數。[18][19]
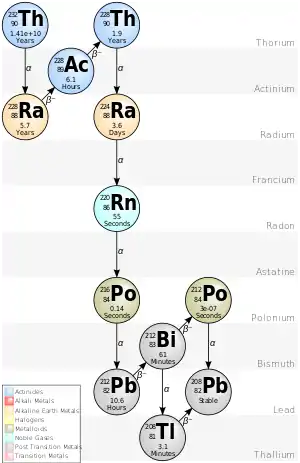
目前已鑑別出三十種放射性同位素,核子數從209[20]到238。[18]在232Th後,最穩定的同位素分別為230Th(75,380 年)、229Th(7,340 年)、228Th(1.92 年)、234Th (24.10 天)及227Th (18.68 天)。這些同位素都是232Th、235U、238U及237Np衰變鏈的一部份,因此得以痕量存於自然之中。最後的237Np因其較短的半衰期(214萬年),早已消逝在自然中,但仍持續因鈾礦補捉中子而存活數分鐘。所有剩餘的釷同位數的半衰期都短於30天,其中的大部份的半衰期比十分鐘短。[9]
在深海中,同位素230Th佔了自然釷的0.04%。[1] 這是因為其母核種238U可溶於水,但230Th不溶且會沈澱。含有低濃度釷的鈾礦,可以純化出數克的釷樣品,其中230Th佔了四分之一,因為230Th是238U的後續核種。[18]國際純化學和應用化學聯合會(IUPAC)在2013年重新在釷分類成雙核種元素,釷在過去曾被認為是單核種元素。[1]
釷有三個同核異構體(或稱為亞穩態),分別是216m1Th、216m2Th及229mTh。229mTh的激發能在同核異構體中是最低的,[21]約為7.6±0.5 eV。這激發能是如此之低以致於它會進行異構體躍遷,放出的γ射線落在紫外線範圍。[22][23][lower-alpha 4]
釷的不同同位素化學性質相同,但物理性質有著微小的差異。舉例來說,228
Th、229
Th、230
Th及232
Th的密度分別為11.5、11.6、11.6及11.7 g/cm3。[25]同位素229
Th被預測可進行核裂變,其裸臨界質量為2839公斤,在運用鋼反射板可降至994公斤。[25][lower-alpha 5]232
Th不能核分裂,但它是增殖性材料,
在補獲中子後可經由β衰變轉換成易分裂的233U。[25][26]
放射性定年法
有兩種放射性定年法牽涉到釷的同位素,分別是建基在234U衰變至230Th的鈾釷定年法,及測量232Th及230Th比例的ionium-釷定年法,[lower-alpha 6]這兩個方法成立是因為232Th是原初放射性元素,230Th只是238U的衰變鏈的中間產物。[27] 鈾釷定年法是相對短期的方法,因為234U及230Th的半衰期比地球年齡來得短。它伴隨著一個姊妹過程,牽涉到235U到231Th的α衰變,然後很快的變成長壽的231Pa,這過程常用來驗證鈾釷定年法的結果。鈾釷定年法常被用來判定含碳酸鈣物質的年代,像是鐘乳石及珊瑚。因為鈾比釷及鏷更溶於水,所以釷及鏷較會沈澱到海床上,其比例就可被測定。這方法的的適用範圍有數十萬年。[27][28]Ionium-釷定年法是相關的過程,利用了釷不溶於水(232Th及230Th都不溶於水)的特性,所以可測量海裡沈積物中的232Th及230Th比例,來判定沈積物的年代。[29][30]這兩種方法都假設,232Th及230Th比例在沈積物層形成時是固定的,沈積物中不含由鈾衰變出的釷,釷也不會在沈積物層間移動。[29][30]
化學性質
釷原子有90個電子,其中四個電子為價電子。理論上價電子有三個原子軌域可以填:5f、6d及7s。[31]儘管釷位於週期表中的f區塊,它的基態有著異常的[Rn]6d27s2電子組態。5f及6d子殻層在早期錒系元素中能量相當接近,甚至比鑭系元素中的4f和5d子殻層還近,而釷的6d子殻層比5f子殻層能量低,因為它的5f子殻層並未被完全填滿的6s及6p子殻層良好遮蔽,所以較不穩定。這是因為相對論效應,更精確的說是自旋-軌道作用,在週期表底部變得更為重要。釷原子的5f、6d及7s的能量相近,導致釷幾乎總失會失去它的四個價電子,並處於它的最高可能氧化態+4。這和釷的同族鑭系元素鈰不同,鈰的最高氧化態也是+4,但是+3氧化態更為重要也更為穩定。比起鈰,釷的游離能和氧化還原電位更像是過渡金屬鋯及鉿,所以釷的化學性質也是像鋯及鉿。這種類過渡金屬的性質是前半段錒系元素的準則。[32][33]
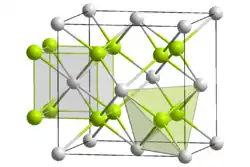
雖然氣態釷原子有著異常的電子組態,5f在釷金屬裡扮演了重要角色。這首先在1995年被認識到,如果釷的電子組態是[Rn]6d27s2,且5f軌域在費米能階之上,那麼釷的晶體會像是4族元素的鈦、鋯及鉿一樣,是六方最密堆積,而不是實際上的面心立方堆積。只有在考慮5f之後,才能解釋真實的晶體結構。釷的+3氧化態的電子組態[Rn]5f1,5f在其稀有和極不穩定的扮演的角色也很清楚。[34]
四價釷化合物的顏色通常是無色或是黃色,像是銀或鉛一樣,因為Th4+也沒有5f或是6d電子。[5]所以釷的化學內容,大部份是易帶正電的金屬,形成了一個反磁性的且有穩定惰性氣體組態的離子,這暗示了釷及s區塊主族元素的相似性。.[35][lower-alpha 7]釷和鈾是最常被探討的放射性元素,因為它們的放射性足夠低,不需要特別的訓練來處理。[36]
反應性
釷的反應性極高,而且是易帶正電的金屬。Th4+/Th的標準還原電位為−1.90 V,釷的電正度比鋯及鋁更高。[37]切成細塊的釷金屬會自燃。[3]當在空氣中被加熱時,釷屑會被點燃,焰色為亮白光並產生二氧化釷。塊狀純釷與空氣的反應則相對緩慢,雖然在數月後有可能發生腐蝕現象。大多的釷樣品都含有不同程度的二氧化釷,而加快了腐蝕過程。[3]這些樣品會逐漸失去光澤,表面變灰最後變成黑色。[3]
在標準狀況下,釷會逐漸被水侵蝕,但不會快速溶於大多常見的酸中,除了氫氯酸以外,釷會溶於其中,並留下黑色的不可溶殘留物ThO(OH,Cl)H。[3][38]釷會溶於含有少量氟離子或氟矽酸的濃硝酸中,[3][39]若不含這兩者,則會像鈾及鈽一樣被硝酸鈍化。[3][40][41]
-fluorid.png.webp)
Th4+: __ / F−: __
無機化合物
大多釷與非金屬的的二元化合物,可用加熱混合物的方式製備。[42]在空氣中,釷會燃燒形成ThO2,晶體結構為螢石。[43]二氧化釷是耐火材料,在所有氧化物中具有最高的熔點(3390 °C)。[44] 它會潮解,並會與水與許多氣體快速反應,[45]並易溶於含氟離子的濃硝酸中。[46]當加熱時,會放出強藍光,當二氧化釷與其較輕的同族化合物二氧化鈰時,光會變成白色,這是過去釷最常見的應用,也就是被用於煤氣網罩的原理。[45]此效果不需要火焰,在1901,人們發現Welsbach煤氣網罩(由ThO2 with 1% CeO2組成),在暴露在冷的未燃氣體與空氣之中時,會維持在全光狀態。[47]二氧化釷發出光的的波長,比同溫下的白熾物發出的黑體輻射短,此現象稱作為強熱發光。這是因為 二氧化釷與鈰在火焰中的高濃度自由基的重新結合中扮演著催化劑的角色,這個結合會放出大量能量。1%的二氧化鈰的加入,加強了可見光區的發射率。此外鈰不像釷,可以處於多個氧化態,它的價數及可見光的發射率會與火焰的發生區域有關(區域不同,化學組成不同,價數也不同)。[47]已發現數個釷與氧族(硫、硒及碲)的化合物,以及與氧族(硫、硒及碲)及氧結合的化合物。[48]
所有四種四鹵化釷化合物都存在,也有一些低價數的溴化物及碘化物。[49]四鹵化合物都是八配位並都可潮解,易溶於像是水的極性溶劑。[50]許多相關的多鹵化物離子也已被發現。[49]四氟化釷有著單斜晶系的晶體結構,與四氟化鋯及四氟化鉿相同,其中Th4+離子與F−離子以扭曲四角反稜柱的方式結合。[49]其它的四鹵化物則有著十二面體的幾何形狀。[50]較低價數的碘化物像是ThI3(黑色)與 ThI2(金色)可以用釷金屬去還原四碘化釷來得到,它們只含有Th4+而不含有Th(III)與Th(II),可以電子鹽的形式更清楚的寫下化學式。[49]許多氟化釷、氯化釷及溴化釷可以和鹼金屬、鋇、鉈及銨形成多元鹵化物。[49]舉例來說,以氟化鉀及氫氟酸處理後,Th4+形成錯陰離子ThF2−
6,並形成沈澱物K2ThF6。[39]
溴化釷、碳化釷、矽化釷及氮化釷皆是防火材料,像是對應的鈾化物及鈽化物一樣。這些化合物因可能成為核燃料而引起關注。[42]所有四個更重的氮族化物(磷、砷、銻及鉍)皆以二元釷化合物的方式存在。鍺化釷也有被發現。[51]釷會與氫反應形成氫化釷像是ThH2及Th4H15,後者在溫度低於7.5–8 K形成超導體,常溫常壓下導電性質則像是金屬。[52]氫化物熱力學上不穩定,暴露在空氣或濕氣後會很快的分解。[53]

配位化合物
在酸性水溶液中,釷以四價水離子[Th(H2O)9]4+的方式存在,形狀為三側錐三角柱,[54][55]在 pH < 3時,釷鹽溶液中的陽離子大都是此形式。[54]Th4+離子是最大的四價錒系元素離子,隨著配位數的不同,其半徑範圍為0.95到1.14 Å。[54]因其高電荷它相當酸,比亞硫酸稍強,所以它傾向進行水解及聚合(程度比Fe3+輕),在pH為3或更低的溶液中,主要形成[Th2(OH)2]6+。在鹼性較高的溶液中,會繼續聚合成凝膠狀Th(OH)4沈澱出來(雖然平衡可能需數星期才能達成,因為聚合反應通常在沈澱之前就會慢下來)。[56]身為一個硬路易士酸,Th4+喜好 以氧原子為施體的硬配基,與以硫原子為施體形成的錯合物較不穩定,也更容易水解。[32]
因釷的尺寸較大,高配位數為其主要規則。五水硝酸釷是第一個發現的配位數為11的化合物,四水草酸化物配位數為10,硼氫化物(在曼哈頓計劃第一次製備)配位數則為14。[56]這些釷鹽以在水及極性有機溶劑中的高溶解度而知名。[5]
已發現許多其它的與多原子陰離子形成的無機釷化合物,像是過氯酸鹽、硫酸鹽、亞硫酸鹽、硝酸鹽、碳酸鹽、磷酸鹽、釩酸鹽、鉬酸鹽、鉻酸鹽及它們的氫化形式。[57]它們在釷的純化過程及處理核廢料中很重要,但它們大多數的性質皆未被全面了解,尤其是它們的結構性質。[57]舉例來說,硝酸釷是經由氫氧化釷與硝酸反應而成,溶於水及酒精中,在釷及其化合物的純化中是重要的中間物。[57]釷與有機配基形成的錯合物,像是草酸、檸檬酸與EDTA穩定得多。在自然含釷的水中,有機釷錯合物的濃度通常比無機釷錯合物大上幾個數量級,即使無機配基的濃度比有機配基高得多時也是如此。[54]
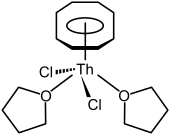
有機釷化合物
大多有關有機釷化合物專注在環戊二烯基及環辛四烯基上。就像許多前中段的錒系元素(一直到鋂,鋦也有可能),釷會形成環辛四烯錯合物,黃色的Th(C8H8)2,二茂釷,它的結構與更知名的二茂鈾相同。[58] 它可以用四氯釷與K2C8H8,在THF溶劑裡及乾冰溫度下反應而製得,也可用四氟化釷與MgC8H8反應。[58]它在空氣中不穩定,並在水中或190 °C下分解。[58]也有發現半三明治的化合物,像是(η8-C8H8)ThCl2(THF)2,有著鋼琴凳結構,可經二茂釷及四氯化釷在四氫呋喃裡反應而得。[32]
最簡單的環戊二烯化合物是Th(C5H5)3及Th(C5H5)4,有許多已知的衍生物。前者(有兩種形態,紫色和綠色)是一個釷的形式氧化態為+3的稀有例子,[58][59]在某衍生物中也存在+2的形式氧化態。[60]氯衍生物[Th(C5H5)3Cl]可經加熱四氯化釷與限量的K(C5H5)(也可使用其它的單價環戊二烯金屬化合物)製得。烷基及芳基衍生物可由氯衍生物得到,並曾被用來研究釷碳σ鍵。[59]
其它的有機釷化合物並未被詳細研究。已發現四苄基釷(Th(CH2C6H5))及四丙烯基釷(Th(C3H5)4),但其結構並未確定。它們在室溫下緩慢分解。釷會形成側錐三角柱形的七甲基釷根離子 ([Th(CH3)7]3−),此離子會形成鹽類[Li(tmeda)]3[ThMe7](tmeda= Me2NCH2CH2NMe2)。雖然只有一個甲基只接到釷原子上(釷碳距離為257.1 pm),其它六個與釷鋰原子相接(釷碳距離為265.5–276.5 pm),它們在溶液中的性質表現是一樣的。四甲基釷Th(CH3)4並未被發現,但它的加合物被膦类配体所穩定。[32]
存量
生成方式
232Th是原初核種,已以現有形式存在數百億年。它在逝去中的恆星核裡,經由R-過程而形成,並由超新星及中子星碰撞散布到銀河系中。[61][62]字母R代表快速(rapid)中子補獲,發生於核心坍縮的超新星中,重啟始核種像是56Fe快速補獲中子,沿著中子滴線上升,因中子補獲過程比β衰變回到更穩定的核種快得多。中子補獲是恆星唯一合成超鐵元素的方法,因為在高原子序數下,庫侖障壁的上升使得帶電粒子間的交互交用更加困難,事實上在56Fe後的核融合為吸熱反應。[63]因為在209Bi後穩定性急促的下降,R-過程是唯一能在星系核種合成中可以產出釷及鈾的過程,所有其它的過程都太慢,中間產物在補獲到足夠的中子前就發生α衰變,無法繼續反應產生這些元素。[61][64][65]
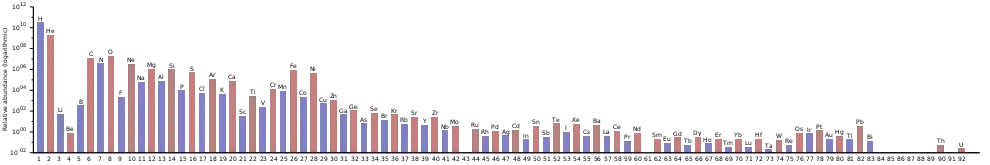
在宇宙中,釷是最稀有的原初元素之一,因為它是兩個只能經由R-過程產生的元素之一(另一個為鈾),也因為它自生成的那刻起就不斷的緩慢衰變。比釷稀有的原初元素有銩、鎦、鉭、錸、在r過程豐度圖的第三根峰也就是重鉑系金屬元素前,帶奇原子數的核種、最後還有鈾。[61][63][lower-alpha 8]在遙遠的過去,鈽及鋦的同位素的衰變會增加釷及鈾的豐度;而釷相對於鈾的豐度,會因236U衰變至232Th以及235U的自然枯竭而增加,但這些來源早已衰變殆盡且不再造成影響。[66]
在地殼中,釷的存量則高得多,大約佔了8.1 ppm,它是存量最多的重元素之一,幾乎和鉛一樣多(13 ppm)且比錫(2.1 ppm)多。[67]這是因為釷喜歡形成不會沈入地心的氧化礦物,它被歸類成親岩元素。常見的釷化合物也難溶於水,所以即使難熔金屬在地球上與整個太陽系的存量差不多,地殼中可採集的釷也比其它重鉑系金屬多。[68]
地球存量
自然的釷幾乎都是純232Th,它有著最長的生命且是釷最穩定的同位素,其半衰期與宇宙年齡相當。[18]它的放射衰變熱是地熱的主要來源,地熱其它主要的貢獻來自於短命的原初放射核種,依貢獻從多到少排列有238U、40K、以及235U。(在地球形成之初,40K及235U貢獻更多因為它們的衰變得更快放出更多熱,也因衰變得快所以存量減少,現今主要貢獻者為232Th及238U。)[73]它的衰變使得地球上釷存量緩慢減少,地球現有釷存量是形成之初的85%。[44]其它自然的釷同位素壽命短得多,其中通常只有230Th可被檢測得到,它與其母核種238U達成長期平衡,最多可佔自然釷存量的0.04%。[18][lower-alpha 9]
只能在大多數礦物的少量成份中發現釷,所以釷在早先被視為稀有。[75]土壤正常含有6 ppm的釷。[76]
自然界中,釷以+4氧化態存在,與鈾(IV)、鋯(IV)、鉿(IV)、鈰(IV)、鈧、釔以及其它三價鑭系元素有著差不多的離子半徑。[75]因為釷有放射性,含釷的礦物通常是輻射變晶(非晶形固體),它們的晶體結構被釷的α射線所破壞。[77]矽鈣鈾釷礦((Ca,Fe,Pb)2(Th,U)Si8O20)是一個極端例子,因其含有的釷而從未被發現不是輻射變晶的情形。[78]
因為在世界各地有大型礦床,獨居石(主要是不同稀土元素的磷酸鹽)是釷最重要的商業來源,主要產區有印度、南非、巴西、澳洲及馬來西亞。它的釷含量平均有2.5%,在某些礦床則可高達20%。[75][79]獨居石為黃或棕色,成砂狀;化學穩定性高,所以難以從中萃取出釷。[75]褐廉石(主要是不同金屬的氫氧矽酸鹽)可含有0.1–2%的釷,鋯石(主要是矽酸鋯)可含有0.4%的釷。[75]
氧化釷存在於稀有礦物方釷石礦中,因為其與二氧化鈾為同型礦物,這兩種常見的錒系元素氧化物可以形成固態溶液,其名稱則因ThO2的含量而有所不同。[75][lower-alpha 10] 釷石(主要是矽酸釷,ThSiO4)的釷含量也很高,也是首次發現釷的礦物。[75]在矽酸釷礦裡,Th4+及SiO4−
4 離子常被M3+(M= Sc, Y, or Ln)及磷酸根(PO3−
4)所取代。[75]因二氧化釷極其難溶,在釋放時,釷通常無法很快地散布於環境之中。Th4+離子可溶,尤其在酸性土壤之中,在酸性條件下釷離子濃度可高達40 ppm。[44]
歷史
錯誤的報告
在1815年,瑞典化學家永斯·貝吉里斯分析了從瑞典中部城市法倫的銅礦中得來的不尋常矽鈹釔礦樣本,他注意到一個白色礦物的浸漬痕跡,並謹慎地假設其為某種未知元素的氧化物。貝吉里斯已經發現了兩種元素,鈰及硒。但他也曾錯誤地公開發表了一個新元素gahnium,後來發現其實是氧化鋅。[81]在1817年,貝吉里斯私下裡以北歐神話的雷神Thor,分別將這假定的元素及其推定的氧化物為命名為thorium及thorina。[82][83]在1824年,在揶威的西阿格德爾郡發現了更多相同礦物的礦床後,他撤回了他的發現,因為這個礦物(後被命為磷釔礦)被證明大多是正磷酸釔。[26][81][84][85]
發現
在1828年,Morten Thrane Esmark在挪威泰勒馬克郡的Løvøya島上發現了一種黑色礦物。他是挪威的神父,也是一個業餘的礦物學家,在泰勒馬克郡研究礦物,並在當地擔任神職人員。他常將最有意思的標本,像是這個,寄給他父親Jens Esmark。他父親是知名的礦物學家,也是克里斯蒂安尼亞(今奧斯陸)皇家腓特烈大學的礦物學及地質學教授。[86]老Esmark判定這不是已知的礦物,並寄了份樣本給貝吉里斯尋求鑑定。貝吉里斯判定這含有一種新元素。[26]在1829年,在利用鉀金屬還原 KThF5,分離出不純的樣品後,他發表了他的發現。[87][88][89]貝吉里斯重用了之前誤判新元素的名稱[87][90],將這個礦物命名為thorite。[26]

貝吉里斯對這新金屬元素及其化學化合物做了初步的鑑定,他正確地得到了氧化釷中的釷氧質量比7.5(真確值約為7.3),但他假設這新元素是二價而非三價,所以算出的原子量為氧 原子量的7.5倍(120 amu),實際上的量應為氧的15倍。[lower-alpha 11]他判定釷是一種電正度很高的金屬,其電正度比鈰高但比鋯低。[91]金屬形態的釷在1917年第一次被荷蘭企業家Dirk Lely Jr.及Lodewijk Hamburger分離出來。[lower-alpha 12]
初期化學分類
在1869年由門得列夫發表的週期表中,釷及稀土元素被放置在週期表主體之外,也就是在每個垂直週期的底部,鹼土金屬的後面。這反映出了當時認為釷及稀土元素是二價的。之後得知釷及大部份稀土元素是四價,門得列夫在1871年將鈰及釷移到第四族,該族也包含了現代的碳族(第十四族)及鈦族(第四族),因為它們最大的氧化態是+4。[94][95]鈰很快地從週期表主體中移除,改放到分開的鑭系元素中;釷則是因為與其它較輕的第四族元素,像是鈦及鋯,有著類似的性質,而留在第四族裡。[96][lower-alpha 13]
初期應用
釷在1828年被發現,當到了1885年才開始被應用 奧地利化學家Carl Auer von Welsbach發明了煤氣網罩,一種可攜帶的光源,在燃燒可燃氣體加熱時會因氧化釷的白熾現象而放光。[26]之後發現了許多釷及其化合物的應用,包括了陶瓷、碳弧光燈、抗熱坩堝及工業化學反應的催化劑,像是把氨氧化成硝酸。

放射性
在1898年,釷第一次被德國化學家Gerhard Carl Schmidt觀測到具有放射性,之後波裔法國物理學家瑪麗·居禮也獨立發現此事。在1896年法國物理學家亨利·貝克勒發現鈾有放射性後,釷是第二個被發現具有放射性的元素。[97][98][99]從1899年開始,紐西蘭物理學家歐尼斯特·拉塞福及美國電子工程師Robert Bowie Owens研究釷的放射線,早期觀察顯示它變化幅度巨大。後來他們確定了這些變化來自於一個釷的短命氣態子核種,而且發現這是一個新元素。這元素現被命名為氡,除了鈾以外,是唯一一個在自然中以釷的子核種被發現的放射性元素。[100]
在計入氡的貢獻後,拉塞福,現與英國物理學家弗雷德里克·索迪合作,在1900年到1903年的工作中,證明了釷是如何隨著時間以穩定速率,衰變成一系列的其它元素。這觀察引起弜 半衰期的鑑定,也就是α粒子實驗成果之一,而這又導致了放射性的蛻變理論。[101]放射性的生物效應發現於1903年。[102]這新發現的放射性現象激勵了科學家及一般大眾。在1920年代,釷的放射性被宣傳為風濕、糖尿病及性無能的解藥。1932年,在聯邦調查放射性的健康影響後,這類使用大多在美國被禁止。[103]在美國,約一萬人在X光診斷時被注射釷,他們之後被發現健康出了問題,像是白血病及異常染色體。[44]大眾對於放射性的興趣在1930年末已消退。[103]

進一步分類
直到十九世紀末,化學家一致認為釷及鈾就像鉿及鎢的類比,第六排的鑭系元素被認為是僅有一次的意外。在1892年,英國化學家Henry Bassett假設了第二個額外的週期表長排,以容納已知及未發現的元素,並將釷及鈾類比成鑭系元系。1913年,丹麥物理學家尼爾斯·波耳發現了原子及電子軌域的理論模型,後快的得到了廣泛認同。此模型指出了週期表的第七排過渡金屬,在填d殼層之前應先填進f殼層,就像第六排中鑭系元素位於5d過渡金屬之前。[94]第二個內過渡系列以錒系元素的型式存在,並未被接受,直到鑭系元系的電子結構相似性被建立之後,才有所改變。[104]波耳建議5f軌域有可能延至鈾之後才被填入。[94]
直到發現第一批超鈾元素中從鈽之後的氧化態像是鑭系元素一樣主要為+3及+4後,才理解到錒系元系的確是先填入f軌域而非是d軌域,而前段錒系元素的有著類似於過渡金屬的化學性質只是例外而非規則。[105]在1975年,在美國物理學家格倫·西奧多·西博格與他的團隊發現超鈾元素鋂及鋦後,他理解到釷是錒系元素的第二個成員,並位於f區塊中,而非是位於第四d區塊,鉿的較重同族元素。[96][lower-alpha 14]
逐步淘汰
在1990年代,因為安全性及環保考量,隨著發現更安全的適當替代物後,大多與釷的放射性無關的應用也快速減少。[26][108]儘管釷有放射性,在無法找到適當替代物時,釷依然被使用。1981年,一份由美國橡樹嶺國家實驗室的研究估計,在每週末使用釷煤氣網罩,對一個人來說是安全的,[108]但這不適用於製造網罩的工人及一些工廠附近的土壤。[109]有些製造商已改用其它材料,像是釔。[110]直到2007年,一些公司仍持續製造販賣釷網罩,且未提供與其放射性相關的適當訊息,有些公司更偽稱它們不具有放射性。[108][111]
核能發電

釷在原型層級上已被用做電力來源。最早的釷反應爈建於1962年,位於美國紐約洲的Indian Point能源中心。[112]印度有世界上最大釷供應地之一,但印度的鈾存量並不多。在1950年代,印度尋求能源獨立,推立了三階段核能計劃。[113][114]在大多數國家,鈾存量相對得多,而釷反應爈的進度緩慢;在廿世紀,有三個反應爈建於印度,十二個建於他處。[115] 1996年,國際原子能總署開始了釷反應爈的大規模研究;一年後,美國能源部也開始研究。以色列臺拉維夫大學的Alvin Radkowsky是賓夕法尼亞州碼頭市核電站的首席設計師,第一個美國民用釷滋生反應爈。他建立了一個集團來研發釷反應爈,包括了其它實驗室: Raytheon Nuclear Inc.、美國的布魯克黑文國家實驗室及俄羅斯的庫爾恰托夫研究所。[116]在廿一世紀,釷潛在的減低核擴散能力及它的廢料特性重新引起了釷燃料循環的興趣。[117][118][119]
生產
| 國家 | 儲量 |
|---|---|
| 846 | |
| 632 | |
| 595 | |
| 595 | |
| 380 | |
| 374 | |
| 300 | |
| 172 | |
| 155 | |
| 148 | |
| 100 | |
| 87 | |
| 86 | |
| 60.5 | |
| 50 | |
| 50 | |
| 其它國家 | 1,725 |
| 世界總儲量 | 6,355 |
釷的需求量不高,只從礦石提鍊釷並不划算,所以釷幾乎都是隨著稀土元素一起被提鍊,稀土元素則有可能是其它礦物生產時的副產物。[122]現在依靠獨居石來做生產來源,是因為釷主要是以副產品來生產;若是釷的需求量上升,可以輕易地採用其它含釷量更多的來源,像是釷石。[123]現有對於釷資源的分布知識貧乏,因為需求不大所以相對地花費較少精力去探索。在2014年,可用來萃取釷的濃縮獨居石的世界產量大約有2700噸。[124]
常見釷的生產過程包括了從濃縮物中的萃取以及純化,接下來可以選擇轉成化合物,像是氧化釷。[125]
濃縮
可用來萃取釷的釷礦物可分兩大類:原生礦床及次生礦床。原生礦床發於酸性花崗岩岩漿及偉晶岩中,濃度高但尺寸小;次生礦床則發於花崗岩山區河口處。在這些礦床中,釷與其它重礦物一起被濃縮。[37]初始濃度隨著礦床種類而有所不同。[125]
在原生礦床裡,通常由採礦得到偉晶岩後,分成小塊再進行浮選。碳酸鹼土金屬鹽可用氫氯酸反應而移除,接下來進行稠化、過濾及鍛燒,可得稀土元素含量上達90%的濃縮物。[125]次生礦物(像是海砂)則先進行重力分離,再以一系列漸強的磁鐵進行磁力分離。以此法得到的獨居石純度可達98%。[125]
廿世紀的工業生產法,是先在鑄鐵容器以熱濃硫酸處理,再以水稀釋並進行選擇沉澱。此法依賴於技術上的細節及濃縮物顆粒的大小。曾有許多替代方法被提出,但只有一種被證明經濟實惠:以熱氫氧化鈉進行鹼消化。這比原法更貴,但產出更純的釷,特別的是此法可從濃縮物中移除磷酸鹽。[125]
酸消化處理
酸消化處理包括兩過程,並用到了溫度210–230°C,濃度高度93%的硫酸。首先加入60%的硫酸,稠化反應物。再來加入發煙硫酸,並保持定溫五小時以降低稀釋後的體積。硫酸濃度依反應速度及黏度而定,兩者皆隨著濃度上升而增加,但黏度增加會使反應變慢。升溫也會加速反應,但需避免超過300°C,因為這會產生不可溶的焦磷酸釷。因為溶解會放出很多熱,獨居石砂不可太快的加入酸裡。相反的在溫度低於200°C時,反應會太慢以致於不實際。為了保證沒有沈澱物會析出於獨居石表面而阻礙反應,酸的量必須是石砂的兩倍,而不是化學計量得出的60%。之後將混合物卻至70°C ,並以十倍體積的冷水稀釋,如此一來所有剩餘的獨居石會沈於底部,而稀土元素及釷會留在溶液中。之後釷可以在pH 1.3下以磷酸鹽沈澱而分離, 因為稀土元素直到pH 2才會沈澱。[125]
鹼消化處理
鹼消化是以30–45%的氫氧化鈉溶液在140°C處理約三小時。太高溫會產出難溶的氧化釷,留下過量的鈾在濾液裡;鹼液濃度太低則會使反應非常緩慢。這些反應條件相當溫和,需要獨居石砂的大小在45 μm以下。在過濾之後,濾餅會含有以氫氧化物形式存在的釷及稀土元素、以重鈾酸鈉形式存在的鈾與以磷酸鈉形式存在的磷酸。降溫至60 °C以下時,此濾餅會析出十水磷酸鈉的晶體;反應物中有二氧化矽時,鈾不純物的量會上升,在商業使用前需重新結晶。氫氧化物會在80°C溶解於37%的氫氯酸。過濾剩餘的沈澱物後,再加入47%的氫氧化鈉,會在約pH 5.8左右沈澱出釷及鈾。需避免乾燥沈澱物,因為空氣會氧化鈰到+3或+4的氧化態,而鈰(IV)可以從氫氯酸中釋放出氯。稀土元素會在高pH值時再次沈澱,沈澱物會被原有的氫氧化鈉溶液中和,雖然大部份的磷酸必須先移除以避免稀土元素磷酸鹽的沈澱。也可先將濾餅溶於硝酸後,再用溶劑萃取出釷及鈾。氫氧化釷會綁住釷而妨礙其完全溶解。[125]
現代應用
自1950年代起,[126]因釷及其衰變產物的放射性導致環境上的考量,與放射性無關的應用已逐漸下滑。[26][108]
大多數釷的應用,使用了它的氧化物(在工業界有時稱之為thoria)而非釷金屬。這化合物熔點高達3300°C(6000°F),是所有已知氧化物中最高的,只有少數物質的熔點比它高。[44]這有助於化合物在火焰中保持固態,而且它明顯增加了火焰亮度,這是釷被用在煤氣網罩的主要原因。[127]所有物質在高溫時都會放出能量(發光),但釷放出的光幾乎全是可見光,所以釷製網罩才會這麼亮。[47]當釷暴露在能量來源中時,釷會散發出能量,其中有些能量是以可見光的形式釋放,能量來源則有可能是陰極射線、熱源或是紫外線。氧化鈰也有這效應,並在將紫外線轉成可見光時有著更高的效率,但是氧化釷有著更高的火焰溫度,並放出較少的紅外線。[127]釷仍常被用在網罩中,但自1990年代後期已逐漸被釔取代。.[128]份由英國國家輻射防護局在2005年發佈的評論指出,「雖然(釷製煤氣網罩)在數年前還非常容易取得,但現今已不再是如此。」[129]

在製造白熾燈絲時,在抽出燈絲前,在鎢的燒結粉末加入少量的二氧化釷,可有效降低鎢的再結晶。[126]在鎢製熱陰極中加入少量的釷,可有效降低電子的功函數,所以電子可在低得多的溫度被射出。[26]釷會在鎢表面形成一原子厚的釷層。釷表面的功函數之所以會降低,有可能是因釷較大的電正性而在釷與鎢之間形成的電場所導致。[130]自1920年代起,含釷鎢線被用在真空管、 X射線管的陰極和對陰極、以及整流器裡。因為釷與大氣中氧及氮的反應性,釷也用作真空管中的吸氣劑。1950年代引進電晶體後,此類需求大幅減少,但並未完全消失。[126]在鎢極氣體保護電弧焊中,二氧化釷被用來增加鎢電極的高溫強度以及電弧的穩定性。[26]在這項應用中,氧化釷正被其它氧化物,像是鋯、鈰及鑭的氧化物所取代。[131][132]
二氧化釷被用在耐高溫的陶瓷中,像是實驗室的高溫坩堝,[26],或著是主要成份,或著作為二氧化鋯的添加物。由90%鉑及10%釷的合金,是把氨氧化成氮氧化物的催化劑,但這已被95%鉑及5%銠的合金所取代,因其有著更好的機械性質及更高的耐用度。[126]
作為玻璃的添加物,二氧化釷可增加折射率及降低色散。這種玻璃可用於攝影機及科學器材裡的高品質透鏡。[38]這些透鏡的放射線會讓透鏡變暗,也會在幾年間讓透鏡慢慢變黃,並損害底片,但健康風險不大。[133]發黃的透鏡在長期暴露在強紫外線下後,即可回復透明無色。在此應用中,二氧化釷已被稀土氧化物取代,因為它們提供類似效果但無放射性。[126]
四氟化釷在多層光學塗膜中可用作抗反射材料,它在電磁波段0.35–12 µm的範圍是透明的,大約對應到近紫外線、可見光及中紅外線。它的放射線主要是α粒子,可被另一層薄膜輕易擋下。[134]自2010年代後,四氟化釷的取代物正在研發中。[135]
Mag-Thor合金(也被稱為含釷鎂)被用於航太應用中,但這些應用因其放射性而逐漸淡出。
核能之潛在應用
反應爐的主要核能來源是中子引發的核分裂,合成易分裂[lower-alpha 5]核種 233U及239Pu可經由 自然界存在的232Th及238U補獲中子後而增殖。235U存在於自然界,而且是易分裂核種。[136][137][lower-alpha 15]在釷燃料循環中,可孕同位素232Th被慢中子所轟炸,補獲中子後變成233Th,然後連續β衰變兩次,先變成233Pa再變成易分裂的233U:[26]
- 232
90Th + n → 233
90Th + γ 233
91Pa 233
92U
| 237Np | ||||||||||||||
| ↑ | ||||||||||||||
| 231U | ← | 232U | ↔ | 233U | ↔ | 234U | ↔ | 235U | ↔ | 236U | → | 237U | ||
| ↓ | ↑ | ↑ | ↑ | |||||||||||
| 231Pa | → | 232Pa | ← | 233Pa | → | 234Pa | ||||||||
| ↑ | ↑ | |||||||||||||
| 230Th | → | 231Th | ← | 232Th | → | 233Th | ||||||||
|
以黃色背景斜體 標示的核種,其半生期在30天以下;以粗體標示的核種,其半生期超過一百萬年;以紅框標示的核種為可分裂物質 | ||||||||||||||
233U是易分裂核種,可以用與235U及239Pu一樣的方式當做核燃料。當233U進行核分核時,發射出的中子可以進一步的撞擊232Th核種延續循環。[26]這與快中子增殖反應爐中的鈾燃料循環同時進行,其中238U補獲中子變成 239U,β衰變成239Np後,再β衰變成易分裂核種239Pu。[138]
来源

钍化物往往可以在独居石的沙裡找到(,包含4-12%的二氧化钍,),其它矿物包括与鋯石同晶型的方釷石()和釷石()。榍石和锆石也含少量钍。
在地壳里平均每千克物质含7至13毫克钍,也就是说钍是铀的含量的两至三倍。由于钍亲土,因此在所有硅酸盐中均含少量钍。
澳大利亚、挪威、斯里兰卡、加拿大、美国、印度、拉普兰和巴西开采钍。土耳其有约80亿吨未开采的矿藏。全世界年开采二氧化钍量估计为100万吨。人的骨骼中每千克骨骼质约含0.002至0.012毫克钍。每天通过食物和饮水一个人约进食0.05至3微克钍。[139]
分布
由于目前对于钍的需求不大,对于矿藏分布地區的勘探很少,因此钍资源的分布不是很清楚。[140]一般认为澳大利亚和印度有尤其多的钍矿。
| 国家 | 钍储藏(吨) | 钍储藏基础(吨) |
|---|---|---|
| 澳大利亚 | 300,000 | 340,000 |
| 印度 | 290,000 | 300,000 |
| 挪威 | 170,000 | 180,000 |
| 美国 | 160,000 | 300,000 |
| 加拿大 | 100,000 | 100,000 |
| 南非 | 35,000 | 39,000 |
| 巴西 | 16,000 | 18,000 |
| 马来西亚 | 4,500 | 4,500 |
| 其它国家 | 95,000 | 100,000 |
| 全世界总和 | 1,200,000 | 1,400,000 |
另一个估计来自于2001年经济合作与发展组织发表的数据:[143]
| 国家 | 可靠的储藏估计(吨) | 估计还有的储藏(吨) |
|---|---|---|
| 巴西 | 606,000 | 700,000 |
| 土耳其 | 380,000 | 500,000 |
| 印度 | 319,000 | - |
| 美国 | 137,000 | 295,000 |
| 挪威 | 132,000 | 132,000 |
| 格陵兰 | 54,000 | 32,000 |
| 加拿大 | 45,000 | 128,000 |
| 澳大利亚 | 19,000 | - |
| 南非 | 18,000 | - |
| 埃及 | 15,000 | 309,000 |
| 其它国家 | 505,000 | - |
| 全世界总和 | 2,230,000 | 2,130,000 |
这两组数据中对巴西、土耳其和澳大利亚的估计的差距比较大。
特征

纯钍是银白色的金属,在室温下在它稳定,可以数月保持其金属光泽。它逐渐氧化为灰色,最后为黑色。钍的物理特性与它含多少氧化物有关。一般纯的钍含有百分之零点几的二氧化钍。但是也可以制造极纯的钍。纯钍柔软,延展性能很好,可以冷压滚和拉长。钍具有多晶型性,有两个不同的晶态。在摄氏1400度以上它是面心立方的,在这个温度以下它是体心立方的。水对钍的腐蚀作用很慢。在大多数以及在浓盐酸和它的溶解速度也很慢。在发烟硝酸和王水中它溶解迅速。粉状或者屑状的钍在加温下很容易自燃。其火焰是白色、明亮的。
同位素和裂变序列
在自然界中钍只有一种同位素,它是所有同位素中半衰期最长的。人们以为以下这个衰变系列是从钍开始的,因此它也被称为钍衰变系列:
应用
钍的氧化物被用来制作白炽罩。这样的白炽罩是将布料浸在99%的硝酸钍和1%的硝酸铈溶液中然后点燃制成的。在高温下硝酸钍分解为氧化钍和氧化氮。由于钍的放射性,现在已经不再使用钍来做白炽罩了。
原子工业
在球床反應堆如中钍可以用来制作铀同位素:通过中子射击钍可以变成,后者通过镤衰变为铀。铀的这个同位素可以裂变,当作核电站的燃料使用。由于钍比铀常见得多,因此假如未来铀矿逐渐消耗的话钍可能成为重要的能源来源。今天要经济地使用这个工艺还需要解决许多技术和安全问题。
的时间数据是半衰期
比起铀和钚钍有一个重要的优点:它每吸收一个中子的产量高。它的生产效率比目前使用的和還要高。
这个技术价格高的原因之一是因为产生的中掺有半衰期很短的,使得它的放射性非常高。此外在回收钍的时候也有类似的毛病,因为其中掺有放射性高的。除此之外生产有导致核武器扩散的危险。
1960美国橡树岭国家实验室是最早试验钍循环的实验室之一。他们制造了一座熔盐反应堆来试验这个技术的可行性。由于缺少经费这个项目于1976年停止。
印度拥有大量的钍矿,因此计划在未来完全仅依靠钍作为其核燃料,将铀完全排挤掉。这个雄心勃勃的计划包括快中子和热中子增殖反应堆。
2007年挪威考虑是否将精力集中在钍循环上。
安全
钍的化学毒性估计非常小。它的危险性主要来自其放射性。钍毒性小的原因在于纯钍及其最常见的氧化物的水溶性非常小,在一升水中只能溶0.0001微克的纯钍。只有在酸性非常高、pH值低于4的溶液中它的可溶性才提高。此外草酸也可以提高钍的水溶性。
放射性
钍同位素的半衰期为140.5亿年,它的放射性比铀238还要低。原因是因为由于它的半衰期高,因此它每秒钟衰变的次数少,此外它衰变产物中半衰期比较低的也比较少。钍放射α粒子,因此它被吸入或者食入的话危险比较高。尤其粉状的金属和氧化物能够进入肺,非常危险,会致癌。此外在放置钍和它的化合物的时候要注意它的衰变产物亦可能有放射性,如208Tl可以放射出260万电子伏特的伽马射线。
化合物
按照其在元素周期表中的位置钍在它的化合物中一般以正四价出现,正三价和正二价比较少见。而其盐的溶液中,只存在正四价的钍离子。一个特殊点是锕系元素没有固定整比的碳化合物。
二氧化钍()是所有金属氧化物中熔点最高的,达3300摄氏度。只有少数金属如钨和少数化合物如碳化钽的熔点比它高。
硝酸钍()是一种无色的、容易在水和酒精中溶解的化合物。硝酸钍是制造二氧化钍和金属钍过程中的一个重要环节,在制造白炽罩的过程中也有应用。
氮化钍()由炽热的钍与空气中的氮反应而成,有青铜光泽。在空气中它与水汽反应在数小时内分解。
碳化钍()是黄色的晶体,其熔点为2655摄氏度。碳化钍在约9K时超导。碳化铀和碳化钍的混合物在高温反应堆中作为燃料。这种燃料是将钍和铀的氧化物与碳混合加温到1600至2000摄氏度制成的。
註解
- 鉍的放射性非常微弱,且其半衰期(1.9×1019 年)比地球年齡長得多
- 鑀曾被測得更低的密度,這個測量是在微克等級的樣品上完成,此結果很有可能是因為鑀的極度放射導致了晶體結構的快速崩毀。[7]
- 低於鋨、鉭、鎢及錸,[3]在 在6d過渡金屬中的元素被預測具有高沸點,但其製量過少難以驗證。[8]
- γ射線以從原子核放出而得名,而非它們的波長,所以放射性元素衰變出的γ射線的波長並無特定下限。[24]
- 可核分裂的核種,是指在補獲高能量中子後, 可以進行核分裂的核種(即使機率很低)。有些核種可被低能量的熱中子以高機率引發核分裂,它們被稱為「易分裂核種」。「增殖性材料」是指可以被中子轟炸後產生易分裂核種的核種。臨界質量是指可以持續進行核連鎖反應的球形物質的質量。
- ionium 其實就是230Th。在早期不同同位素不被認為是同一種元素,所以有者不同的名字。
- 和之前錒系元素與過渡元素的相似性不同,與主族元素的相似性大部份止於釷,而未延伸到錒系元素的後半段。因為在共價鍵中5f軌域的貢獻逐漸增加。在常見的錒系元素中,除了釷只剩下鈾。鈾殘存著一些主族元素的特性。除了鈾最常見的兩個氧化態鈾(VI)及鈾(IV),鈾的化學比釷複雜得多,這兩個態與其它更高的形式上失去所有價電子的氧化態不同,這些更高的氧化態行為與p區塊的重主族元素類似。[35]
- 帶偶數質子或偶數中子的同位素一般會比帶奇數的同位素更穩定,奇原子序數的元素最多只有兩個穩定的同位素,偶原子序數的元素則有多個穩定同位素,像是錫(50號元素)有十個。 [9]
- 其它同位素可能伴隨著232Th而出現,但只有痕量大小。如果來源不含鈾,其它唯一會出現的釷同位素是228Th,它存在於232Th的衰變鏈(釷系列)中,228Th與232Th的比例會低於10−10。[18]如果來源含鈾,會出現其它痕量大小的釷同位素,包括從235U衰變鏈(錒系列)中來的231Th和227Th,以及從238U衰變鏈(鈾系列)中來的,存量較多但仍是痕量的234Th和230Th。[18]229Th會從237Np的衰變鏈(錼系列)中產生,所有原初的237Np皆已絕跡,但它仍會由鈾礦的核反應所產生。[74]229Th大多 是人工中子活化的232Th產生的233U的衰變產物,自然產生的229Th極度稀有。[18]
- 75–100 mol% ThO2稱之為方釷石,25–75 mol% ThO2稱之為鈾方釷石,15–25 mol% ThO2稱之為釷瀝青鈾礦,0–15 mol% ThO2稱之為瀝青鈾礦。[75]
- 在當時,包括了釷及自然界中與其緊密伴隨元素的稀土元素被認為是二價,稀土元素的原子量變成了真值的三分之二,釷及鈾則為真值的一半。
- 分離出釷的主要困難不是在於其電正度,而是難以與自然界中與其緊密伴隨的其它稀土元素及鈾分離。瑞典化學家拉爾斯·弗雷德里克·尼爾松,也是鈧的發現者,在1882年曾試圖分離出釷金屬,但無法得到高純度的釷。[92] Lely與Hamburger利用鈉金屬還原氯化釷,得到了純度99%的釷金屬。[93]在1927年,美國工程師 John Marden與Harvey Rentschler發現了一個更簡單的辦法可以達到更高純度,在氯化鈣的存在下利用鈣還原氧化釷。[93]
- 釷也出現在1864年英國化學家約翰·紐蘭茲的週期表中,是其最後且最重的元素,因為早期認為鈾是三價且原子量大約是120,由於鈾絕大多數是六價,此為真值的一半。釷也在1864年英國化學家William Odling的週期表中擔任最重的元素,並處於鈦、鋯及鉭之下。釷並未出現在1862年法國地質學家Alexandre-Émile Béguyer de Chancourtois,1867年德裔美國音樂家Gustav Hinrichs,以及1870年德國化學家尤利烏斯·洛塔爾·邁耶爾等的週期表中,這些週期表均未納入稀土元素及釷。[94]
- 確定5f子殼層是從錒系前段開始被填入,是在1964年下一個元素鑪第一次被合成出來後;當時發現鑪表現像是鉿,就像5f軌域被填滿後所預期的一樣。 [106]現今釷依然因其與鉿的相似性,而有時被稱為「準第四族元素」。[107]
- 十三種半生期超過一年的錒系元素易分裂同位素有229Th、233U、235U、236Np、239Pu、241Pu、242mAm、243Cm、245Cm、247Cm、249Cf、251Cf及252Es。這之中只有235U是自然存在,而且只有233U and 239Pu可從自然核種補獲單中子而得。[137]
參考文獻
- Meija, Juris; 等. . Pure and Applied Chemistry. 2016, 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- Magnetic susceptibility of the elements and inorganic compounds 的存檔,存档日期2011-03-03., in Handbook of Chemistry and Physics 81st edition, CRC press.
- Wickleder, Fourest & Dorhout 2006, pp. 61–63.
- Gale, W. F.; Totemeier, T. C. . Butterworth-Heinemann. 2003: 15–2–15–3. ISBN 978-0-08-048096-1 (英语).
- Tretyakov, Yu. D. (编). . Chemistry of transition elements 3. Academy. 2007. ISBN 978-5-7695-2533-9.
- Johansson, B.; Abuja, R.; Eriksson, O.; 等. . Physical Review Letters. 1995, 75 (2): 280–283. Bibcode:1995PhRvL..75..280J. PMID 10059654. doi:10.1103/PhysRevLett.75.280.
- Haire, R. G.; Baybarz, R. D. (PDF). Le Journal de Physique. 1979, 40: C4–101. doi:10.1051/jphyscol:1979431.
- Fricke, Burkhard. . Recent Impact of Physics on Inorganic Chemistry. Structure and Bonding 21. 1975: 89–144 [4 October 2013]. ISBN 978-3-540-07109-9. doi:10.1007/BFb0116498.
- Audi, G.; Bersillon, O.; Blachot, J.; 等. (PDF). Nuclear Physics A. 2003, 729 (1): 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001. (原始内容 (PDF)存档于24 July 2013). 已忽略未知参数
|citeseerx=(帮助) - de Laeter, John Robert; Böhlke, John Karl; De Bièvre, Paul; Hidaka, Hiroshi; Peiser, H. Steffen; Rosman, Kevin J. R.; Taylor, Philip D. P. . Pure and Applied Chemistry. 2003, 75 (6): 683–800. doi:10.1351/pac200375060683.
- International Union of Pure and Applied Chemistry. (PDF). Pure and Applied Chemistry. 2006, 78 (11): 2051–2066 [27 July 2017]. doi:10.1351/pac200678112051.
- Nagy, S. 2. EOLSS Publications. 2009: 374. ISBN 978-1-84826-127-3.
- Griffin, H. C. . Vértes, A.; Nagy, S.; Klencsár, Z.; 等 (编). . Springer Science+Business Media. 2010: 668. ISBN 978-1-4419-0719-6.
- Beiser, A. (PDF). 6. McGraw-Hill Education. 2003: 432–434. ISBN 978-0-07-244848-1.
- Ramdahl, Thomas; Bonge-Hansen, Hanne T.; Ryan, Olav B.; Larsen, Åsmund; Herstad, Gunnar; Sandberg, Marcel; Bjerke, Roger M.; Grant, Derek; Brevik, Ellen M. . Bioorganic & Medicinal Chemistry Letters. 2016-09-01, 26 (17): 4318–4321. ISSN 0960-894X. PMID 27476138. doi:10.1016/j.bmcl.2016.07.034.
- Deblonde, Gauthier J.-P.; Lohrey, Trevor D.; Booth, Corwin H.; Carter, Korey P.; Parker, Bernard F.; Larsen, Åsmund; Smeets, Roger; Ryan, Olav B.; Cuthbertson, Alan S. . Inorganic Chemistry. 2018-11-19, 57 (22): 14337–14346. ISSN 0020-1669. PMID 30372069. doi:10.1021/acs.inorgchem.8b02430.
- Captain, Ilya; Deblonde, Gauthier J.-P.; Rupert, Peter B.; An, Dahlia D.; Illy, Marie-Claire; Rostan, Emeline; Ralston, Corie Y.; Strong, Roland K.; Abergel, Rebecca J. . Inorganic Chemistry. 2016-11-21, 55 (22): 11930–11936. ISSN 0020-1669. PMID 27802058. doi:10.1021/acs.inorgchem.6b02041.
- Wickleder, Fourest & Dorhout 2006, pp. 53–55.
- Bonetti, R.; Chiesa, C.; Guglielmetti, A.; 等. . Physical Review C. 1995, 51 (5): 2530. Bibcode:1995PhRvC..51.2530B. doi:10.1103/PhysRevC.51.2530.
- Ikezoe, H.; Ikuta, T.; Hamada, S.; 等. . Physical Review C. 1996, 54 (4): 2043–2046. Bibcode:1996PhRvC..54.2043I. doi:10.1103/PhysRevC.54.2043.
- Ruchowska, E.; Płóciennik, W. A.; Żylicz, J.; 等. . Physical Review C. 2006, 73 (4): 044326. Bibcode:2006PhRvC..73d4326R. doi:10.1103/PhysRevC.73.044326. hdl:10261/12130.
- Beck, B. R.; Becker, J. A.; Beiersdorfer, P.; 等. . Physical Review Letters. 2007, 98 (14): 142501. Bibcode:2007PhRvL..98n2501B. PMID 17501268. doi:10.1103/PhysRevLett.98.142501.
- von der Wense, L.; Seiferle, B.; Laatiaoui, M.; 等. . Nature. 2016, 533 (7601): 47–51. Bibcode:2016Natur.533...47V. PMID 27147026. arXiv:1710.11398. doi:10.1038/nature17669.
- Feynman, R.; Leighton, R.; Sands, M. 1. Addison-Wesley. 1963: 2–5 [13 January 2018]. ISBN 978-0-201-02116-5.
- (PDF). Institut de radioprotection et de sûreté nucléaire: 15. [20 December 2010]. (原始内容 (PDF)存档于10 July 2007).
- Wickleder, Fourest & Dorhout 2006, pp. 52–53.
- (PDF). Institute for Structure and Nuclear Astrophysics, University of Notre Dame. [7 October 2017].
- Davis, O. . Department of Geosciences, University of Arizona. [7 October 2017]. (原始内容存档于28 March 2017).
- Rafferty, J. P., , The Geologic History of Earth, Rosen Publishing: 150, 2010, ISBN 978-1-61530-125-6
- Vértes, A., Nagy, S.; Klencsár, Z.; Lovas, R. G.; 等 , 编, 5 2nd, Springer Science+Business Media: 800, 2010, ISBN 978-1-4419-0719-6
- Wickleder, Fourest & Dorhout 2006, pp. 59–60.
- Cotton, S. . John Wiley & Sons. 2006.
- Martin, W. C.; Hagan, L.; Reader, J.; 等. (PDF). J. Phys. Chem. Ref. Data. 1974, 3 (3): 771–779 [19 October 2013]. Bibcode:1974JPCRD...3..771M. doi:10.1063/1.3253147. (原始内容 (PDF)存档于4 March 2016).
- Cotton, S. . John Wiley & Sons. 2006: 150.
- King, R. Bruce. . Wiley-VCH. 1995. ISBN 978-0-471-18602-1.
- Greenwood & Earnshaw 1997, p. 1262.
- Stoll 2005, p. 6.
- Hammond, C. R. 81st. CRC Press. 2004. ISBN 978-0-8493-0485-9.
- Hyde, E. K. (PDF). National Academy of Sciences. 1960 [29 September 2017].
- Greenwood & Earnshaw 1997, p. 1264.
- Moore, Robert Lee; Goodall, C. A.; Hepworth, J. L.; Watts, R. A. . Industrial & Engineering Chemistry. May 1957, 49 (5): 885–887. doi:10.1021/ie50569a035.
- Greenwood & Earnshaw 1997, p. 1267.
- Yamashita, Toshiyuki; Nitani, Noriko; Tsuji, Toshihide; Inagaki, Hironitsu. . J. Nucl. Mater. 1997, 245 (1): 72–78. Bibcode:1997JNuM..245...72Y. doi:10.1016/S0022-3115(96)00750-7.
- Emsley, J. . Oxford University Press. 2011: 544–548. ISBN 978-0-19-960563-7.
- Wickleder, Fourest & Dorhout 2006, pp. 70–77.
- Greenwood & Earnshaw 1997, p. 1269.
- Ivey, H. F. . Journal of Luminescence. 1974, 8 (4): 271–307. Bibcode:1974JLum....8..271I. doi:10.1016/0022-2313(74)90001-5.
- Wickleder, Fourest & Dorhout 2006, pp. 95–97.
- Wickleder, Fourest & Dorhout 2006, pp. 78–94.
- Greenwood & Earnshaw 1997, p. 1271.
- Wickleder, Fourest & Dorhout 2006, pp. 97–101.
- Wickleder, Fourest & Dorhout 2006, pp. 64–66.
- Greenwood & Earnshaw 1997, p. 127.
- Wickleder, Fourest & Dorhout 2006, pp. 117–134.
- Persson, I. . Pure and Applied Chemistry. 2010, 82 (10): 1901–1917. doi:10.1351/PAC-CON-09-10-22.
- Greenwood & Earnshaw 1997, pp. 1275–1277.
- Wickleder, Fourest & Dorhout 2006, pp. 101–115.
- Wickleder, Fourest & Dorhout 2006, pp. 116–117.
- Greenwood & Earnshaw 1997, pp. 1278–1280.
- Langeslay, Ryan R.; Fieser, Megan E.; Ziller, Joseph W.; Furche, Philip; Evans, William J. . Chemical Science. 2015, 6 (6): 517–521. PMC 5811171. PMID 29560172. doi:10.1039/C4SC03033H.
- Cameron, A. G. W. (PDF). Space Science Reviews. 1973, 15 (1): 121–146. Bibcode:1973SSRv...15..121C. doi:10.1007/BF00172440. (原始内容 (PDF)存档于21 October 2011).
- Frebel, Anna; Beers, Timothy C. . Physics Today. 2018, 71 (1): 30–37. Bibcode:2018PhT....71a..30F. ISSN 0031-9228. arXiv:1801.01190. doi:10.1063/pt.3.3815.
- Roederer, I. U.; Kratz, K.-L.; Frebel, A.; 等. . The Astrophysical Journal. 2009, 698 (2): 1963–1980. Bibcode:2009ApJ...698.1963R. arXiv:0904.3105. doi:10.1088/0004-637X/698/2/1963.
- Burbidge, E. M.; Burbidge, G. R.; Fowler, W. A.; 等. (PDF). Reviews of Modern Physics. 1957, 29 (4): 547. Bibcode:1957RvMP...29..547B. doi:10.1103/RevModPhys.29.547.
- Clayton, D. D. . McGraw-Hill Education. 1968: 577–591. ISBN 978-0-226-10953-4.
- Stoll 2005, p. 2.
- Greenwood & Earnshaw 1997, p. 1294.
- Albarède, F. . Cambridge University Press. 2003: 17. ISBN 978-0-521-89148-6.
- Trenn, T. J. . Annals of Science. 1978, 35 (6): 581–597. doi:10.1080/00033797800200441.
- Diamond, H.; Friedman, A. M.; Gindler, J. E.; 等. . Physical Review. 1956, 105 (2): 679–680. Bibcode:1957PhRv..105..679D. doi:10.1103/PhysRev.105.679.
- Rao, M. N.; Gopalan, K. . Nature. 1973, 245 (5424): 304–307. Bibcode:1973Natur.245..304R. doi:10.1038/245304a0.
- Rosenblatt, D. B. . Physical Review. 1953, 91 (6): 1474–1475. Bibcode:1953PhRv...91.1474R. doi:10.1103/PhysRev.91.1474.
- Gando, A.; Gando, Y.; Ichimura, K.; 等. (PDF). Nature Geoscience. 2011, 4 (9): 647–651. Bibcode:2011NatGe...4..647K. doi:10.1038/ngeo1205.
- Peppard, D. F.; Mason, G. W.; Gray, P. R.; 等. . Journal of the American Chemical Society. 1952, 74 (23): 6081–6084. doi:10.1021/ja01143a074.
- Wickleder, Fourest & Dorhout 2006, pp. 55–56.
- Agency for Toxic Substances and Disease Registry. (PDF). 2016 [30 September 2017].
- Woodhead, J. A. (PDF). American Mineralogist. 1991, 76: 74–82.
- Szymański, J. T. (PDF). Canadian Mineralogist. 1982, 20: 65–75.
- Greenwood & Earnshaw 1997, p. 1255.
- . Google Arts & Culture. [26 June 2016] (英语).
- Fontani, M.; Costa, M.; Orna, V. . Oxford University Press. 2014: 73. ISBN 978-0-19-938334-4.
- Ryabchikov, D. I.; Gol'braikh, E. K. . Elsevier. 2013: 1. ISBN 978-1-4831-5659-0.
- Thomson, T. 1. Baldwin & Cradock and William Blackwood. 1831: 475.
- Berzelius, J. J. [Examining some minerals. 1st phosphoric yttria.]. Kungliga Svenska Vetenskapsakademiens Handlingar. 1824, 2: 334–338 (瑞典语).
- . Mindat database. [7 October 2017].
- Selbekk, R. S. . . Kunnskapsforlaget. 2007 [16 May 2009] (挪威语).
- Weeks, M. E. . Journal of Chemical Education. 1932, 9 (7): 1231. Bibcode:1932JChEd...9.1231W. doi:10.1021/ed009p1231.
- Berzelius, J. J. [Investigation of a new mineral and of a previously unknown earth contained therein]. Annalen der Physik und Chemie. 1829, 16 (7): 385–415. Bibcode:1829AnP....92..385B. doi:10.1002/andp.18290920702 (德语). (modern citation: Annalen der Physik, vol. 92, no. 7, pp. 385–415).
- Berzelius, J. J. [Investigation of a new mineral (thorite), as contained in a previously unknown earth]. Kungliga Svenska Vetenskaps Akademiens Handlingar. 1829: 1–30 (瑞典语).
- Schilling, J. [The actual thoritic minerals (thorite and orangite)]. Zeitschrift für Angewandte Chemie. 1902, 15 (37): 921–929. doi:10.1002/ange.19020153703 (德语).
- Leach, M. R. . [16 July 2016].
- Nilson, L. F. [About metallic thorium]. Berichte der Deutschen Chemischen Gesellschaft. 1882, 15 (2): 2537–2547. doi:10.1002/cber.188201502213 (德语).
- Meister, G. (PDF). United States Atomic Energy Commission. 1948 [22 September 2017].
- Leach, M. R. . [14 May 2012].
- Jensen, William B. (PDF). Journal of Chemical Education. 2003, 80 (8): 952–961. Bibcode:2003JChEd..80..952J. doi:10.1021/ed080p952. (原始内容 (PDF)存档于11 June 2010). 已忽略未知参数
|df=(帮助) - Masterton, W. L.; Hurley, C. N.; Neth, E. J. 7th. Cengage Learning. 2011-01-31: 173. ISBN 978-1-111-42710-8.
- Curie, M. [Rays emitted by compounds of uranium and thorium]. Comptes Rendus. 1898, 126: 1101–1103. OL 24166254M (法语).
- Schmidt, G. C. [On the radiation emitted by thorium and thorium compounds]. Verhandlungen der Physikalischen Gesellschaft zu Berlin (Proceedings of the Physical Society in Berlin). 1898, 17: 14–16 (德语).
- Schmidt, G. C. [On the radiation emitted by thorium compounds and some other substances]. Annalen der Physik und Chemie. 1898, 65 (5): 141–151. Bibcode:1898AnP...301..141S. doi:10.1002/andp.18983010512 (德语). (modern citation: Annalen der Physik, vol. 301, pp. 141–151 (1898)).
- Rutherford, E.; Owens, R. B. . Trans. R. Soc. Can. 1899, 2: 9–12.: "The radiation from thorium oxide was not constant, but varied in a most capricious manner", whereas "All the compounds of Uranium give out a radiation which is remarkably constant."(「氧化釷的放射並非常數,變化相當劇烈」,反之「所有鈾的化合物的放射都非常平穩」)
- Simmons, J. G. . Carol. 1996: 19. ISBN 978-0-8065-2139-8.
- Fröman, N. . nobelprize.org. Nobel Media AB. 1996 [11 May 2017].
- Burns, M. . CRC Press. 1987: 24–25. ISBN 978-0-87371-026-8.
- van Spronsen, J. W. . Elsevier. 1969: 315–316. ISBN 978-0-444-40776-4..
- Rhodes, R. 25th Anniversary. Simon & Schuster. 2012: 221–222, 349. ISBN 978-1-4516-7761-4.
- Türler, A.; Buklanov, G. V.; Eichler, B.; 等. . Journal of Alloys and Compounds. 1998,. 271–273: 287. doi:10.1016/S0925-8388(98)00072-3.
- Kratz, J. V.; Nagame, Y. . Schädel, M.; Shaughnessy, D. (编). 2nd. Springer-Verlag. 2014: 335. ISBN 978-3-642-37465-4. doi:10.1007/978-3-642-37466-1.
- Furuta, E.; Yoshizawa, Y.; Aburai, T. . J. Radiol. Prot. 2000, 20 (4): 423–431. Bibcode:2000JRP....20..423F. PMID 11140713. doi:10.1088/0952-4746/20/4/305.
- New Jersey Department of Health. (PDF). A Practitioner's Guide to Patients' Environmental Exposures. 1996, 1 (3): 1–8. (原始内容 (PDF)存档于15 April 2016).
- Toepker, Terrence P. . American Journal of Physics. 1996, 64 (2): 109. Bibcode:1996AmJPh..64..109T. doi:10.1119/1.18463.
- Poljanc, K.; Steinhauser, G.; Sterba, J. H.; 等. . Science of the Total Environment. 2007, 374 (1): 36–42. Bibcode:2007ScTEn.374...36P. PMID 17270253. doi:10.1016/j.scitotenv.2006.11.024.
- Kazimi, M. . American Scientist. 2003 [29 September 2017]. (原始内容存档于1 January 2017).
- Majumdar, S.; Purushotham, D. S. C. . (PDF). International Atomic Energy Agency. 1999 [7 October 2017].
- . World Nuclear Association. 2017 [29 September 2017].
- (PDF). International Atomic Energy Agency. 2005 [23 March 2009].
- Educational Foundation for Nuclear Science, Inc. . : 19–20. ISSN 0096-3402.
- (PDF). International Atomic Energy Agency. 2002 [24 March 2009].
- Evans, B. . ABC News. 2006 [17 September 2011]. (原始内容存档于28 March 2010).
- Martin, R. . Wired. 2009 [19 June 2010].
- . World Nuclear Association. 2017 [21 June 2017].
- Woods, W. K. . Battelle Memorial Institute. 1966. OSTI 79078. doi:10.2172/79078 (英语).
- Stoll 2005, p. 7.
- United States Geological Survey. (PDF). 2012 [12 May 2017].
- . United States Geological Survey. 2017 [6 January 2018] (英语).
- Stoll 2005, p. 8.
- Stoll 2005, p. 32.
- Stoll 2005, p. 31.
- Matson, Tim. . Countryman Press. 2011: 60. ISBN 978-1-58157-829-4.
- Shaw, J.; Dunderdale, J.; Paynter, R. A. (PDF). NRPB Occupational Services Department.
- Pridham, G. J. . Elsevier. 2016: 105. ISBN 978-1-4831-3979-1 (英语).
- Uttrachi, J. . CarTech Inc. 2015: 42. ISBN 978-1-61325-221-5.
- Jeffus, L. . Cengage Learning. 2016: 393. ISBN 978-1-305-49469-5.
- Oak Ridge Associated Universities. . 1999 [29 September 2017].
- Rancourt, J. D. . SPIE Press. 1996: 196. ISBN 978-0-8194-2285-9.
- Kaiser, N.; Pulker, H. K. . Springer. 2013: 111. ISBN 978-3-540-36386-6 (英语).
- Ronen, Y. . Nuclear Science and Engineering. 2006, 152 (3): 334–335. ISSN 0029-5639. doi:10.13182/nse06-a2588.
- Ronen, Y. . Annals of Nuclear Energy. 2010, 37 (12): 1783–1784. doi:10.1016/j.anucene.2010.07.006.
- . World Nuclear Association. 2017 [29 September 2017].
- Emsley J. The Elements, 1992, Clarendon Press Oxford
- K.M.V. Jayaram. (PDF). (原始内容 (PDF)存档于2007-11-28).
- .
- . World Nuclear Association. [2006-11-01].
- (PDF). : pp 45(table 8), 97(ref 78).
- Wickleder, Mathias S.; Fourest, Blandine; Dorhourt, Peter K. . Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean (编). 3rd. Springer Science+Business Media. 2006. ISBN 1-4020-3555-1.
參考書目
- Greenwood, N. N.; Earnshaw, A. 2nd. Butterworth-Heinemann. 1997. ISBN 978-0-08-037941-8.
- Stoll, W. . . Wiley-VCH. 2005. ISBN 978-3-527-31097-5. doi:10.1002/14356007.a27_001.
- Wickleder, M. S.; Fourest, B.; Dorhout, P. K. . Morss, L. R.; Edelstein, N. M.; Fuger, J. (编). (PDF) 3 3rd. Springer-Verlag. 2006: 52–160. ISBN 978-1-4020-3598-2. doi:10.1007/1-4020-3598-5_3. (原始内容 (PDF)存档于14 December 2017).
延伸閱讀
- Martin, Richard. 1st. Palgrave Macmillan. 2012: 240. ISBN 978-0-230-11647-4 (hardback) 请检查
|isbn=值 (帮助). - Hargraves, Robert. . CreateSpace Independent Publishing Platform. 25 July 2012: 482. ISBN 978-1478161295.
外部連結
| 维基共享资源中相关的多媒体资源:钍 |
| 查询維基詞典中的。 |
- 元素钍在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— {{LinkForElement|thorium| }}(英文)
- 元素钍在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素钍在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – {{LinkForElement|thorium| }}(英文)
- International Thorium Energy Organisation – IThEO.org
- European Nuclear Society – Natural Decay Chains
- ATSDR CDC ToxFAQs: health questions about thorium
- FactSheet on Thorium, World Nuclear Association
- Thorium TV – A review of the element
- EnergyFromThorium.com – Content-rich site on Thorium as a future energy source, and its extraction technology
- TED talk by former NASA engineer Kirk Sorensen about Thorium energy production (video)
- India's experimental Thorium Fuel Cycle Nuclear Reactor (NDTV Report)
- Thorium Remix 2011 – 120 minute Creative Commons Share-Alike documentary on Thorium as an energy source
- Newspaper article about thorium power in India
- China Blazes Trail for Clean Nuclear Power from Thorium
- Thorium at The Periodic Table of Videos (University of Nottingham)
- Thorium Deposits of the United States—Energy Resources for the Future? (USGS, 2009)
- 钍




