铪
| 外觀 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
银灰色 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 铪(hafnium)·Hf·72 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 过渡金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·週期·區 | 4 ·6·d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 178.49(2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | [Xe] 4f14 5d2 6s2 2, 8, 18, 32, 10, 2 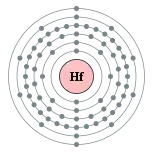 铪的电子層(2, 8, 18, 32, 10, 2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 預測 | 德米特里·门捷列夫(1869年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 固体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 13.31 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點時液體密度 | 12 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | 2506 K,2233 °C,4051 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 4876 K,4603 °C,8317 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | 27.2 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | 648 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | 25.73 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸氣壓
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | 4, 3, 2, 1, −2 ((两性)) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | 1.3(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:658.5 kJ·mol−1 第二:1440 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半徑 | 159 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | 175±10 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 六方密堆积 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 顺磁性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電阻率 | (20 °C)331 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 23.0 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨脹係數 | (25 °C)5.9 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 聲速(細棒) | (20 °C)3010 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 楊氏模量 | 78 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 30 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 體積模量 | 110 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.37 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 5.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 維氏硬度 | 1520–2060 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 1450–2100 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 7440-58-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:铪的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
发现
1923年由荷兰科学家科斯特(D.Coster)和匈牙利科学家喬治·德海韋西(George de Hevesy)由X射线光谱中发现。
背景故事
在莫斯莱对元素的X射线研究后,确定在钡和钽之间应当有16个元素存在。这时除了61号元素和72号元素之外,其余14个元素都已经被发现,而且它们都属于今天所属的镧系,也就是当时认为的稀土元素。
那么72号元素应当归属于稀土元素?还是和钛、锆同属一族?当时多数化学家主张属于前者。法国化学家乌尔班1911年从镱的氧化物中分离出镥后,又分离出一个新的元素。在1914年乌尔班去英国将该元素的样品送请莫斯莱进行X射线光谱检测,得到的结论是否定的,没有发现相当于72号元素的谱线。乌尔班坚信新元素的存在,认为出现这样的结果是因为新研制的机器灵敏度不够,无法检测到样品中痕量新元素的存在。他回到巴黎后与光谱科学家达维利埃共同用第一次世界大战后改进的X射线谱仪进行检测。1922年5月,他们宣布测到两条X谱线,因此断定新元素是存在的。1913年,丹麦物理学家玻尔提出了原子结构的量子论。接着在1921-1922年之间又提出原子核外电子排布理论。玻尔认为根据他的理论,72号元素不属于稀土元素,而和锆一样是同族元素。也就是说,72号元素不会从稀土元素矿物中出现,而应当从含锆和钛的矿石中去寻找。
根据玻尔的推论,在1922年,匈牙利化学家德梅韦西和荷兰物理学家科斯特对多种含锆矿石进行了X射线光谱分析,果真发现了这一元素。他们为了纪念该元素的发现所在地——丹麦的首都哥本哈根,命名它为hafnium,元素符号定为Hf。后来德梅韦西制得了几毫克纯的铪的样品。
来源
它存在于大多数锆矿中,地壳中含量很少。常与锆共存,无单独矿石。
生产

从含钛矿石钛铁矿和金红石的重矿物砂矿石的矿床中可以开采出大量的锆,因此也会产生大部分的铪。[1]锆是一种良好的核燃料棒包覆金属,它具有非常低的中子捕获截面和高温下良好的化学稳定性。然而,由于铪的对中子的吸收性质,锆中的铪杂质将导致其对于核反应堆的有着危害,将锆和铪完全分离对于在核电中的使用是十分必要的。无铪锆的生产会将锆和铪分离,这也是铪的主要来源。[2]

铪和锆的化学性质极其相似,这使得它们难以分离。[3]最初使用的方法是分级结晶法,利用氟代酸铵的溶解度不同,[4]以及分级蒸馏法,利用的氯化物的沸点不同,[5]但它们尚未用于工业化。自从20世纪40年代选择锆作为核反应堆的材料后,相应的分离方法需要得到开发。因此具有多种溶剂的液-液萃取法得到了研究,并且现在仍然用于铪的生产。[6]约半数金属铪是通过锆提纯而产生的副产物得到的。分离的最终产物是四氯化铪。[7]提纯的四氯化铪通过钠或镁对其的还原反应来制备金属铪(克羅爾法)。[8]
- HfCl4 + 2 Mg —1100 °C→ 2 MgCl2 + Hf
Arkel和de Boer开发出了进一步提纯铪的方法,利用了化学传递反应:在密闭容器中,铪与碘在500 °C的温度下反应,形成四碘化铪;再在1700 °C的钨丝上,发生逆反应,分解得到碘和铪。铪在钨丝上形成固体包裹在上面,而碘可以与多余的铪反应,使转化趋于稳定。[9][10]
- Hf + 2 I2 —500 °C→ HfI4
- HfI4 —1700 °C→ Hf + 2 I2
性质
晶体结构有两种:在1300℃以下时,为六方密堆积(α型);在1300℃以上时,为体心立方(β型)。具有塑性的金属,当有杂质存在时质变硬而脆。空气中稳定,灼烧时仅在表面上发暗。细丝可用火柴的火焰点燃。性质似锆。不和水、稀酸或强碱作用,但易溶解在王水和氢氟酸中。
化合物
在大部分铪的化合物中,铪呈现+4价,在溶液中为无色的。二氧化铪、四氯化铪和四碘化铪是常见的化合物。铪盐在水中会发生水解,但倾向比相应的锆盐要小。[11]
铪的化合物Ta4HfC5是目前已知物质中熔点最高的,为4,263 K(3,990 °C)[12];尽管在2015年有模拟计算预测一种Hf-C-N材料的熔点比其高200 K,但尚未经实验证实[13]。
铪可以形成各种各样的配合物,如氟铪酸盐有HfF2−
6、HfF3−
7、HfF4−
8等几种,氯、溴、碘代的铪酸盐有过报道。[14]乙酰丙酮铪[15]、乙醇铪[16]等有机盐也是已知的。
用途
由于它容易发射电子而很有用处,如用作白炽灯的灯丝。铪和钨或钼的合金用作高压放电管的电极用作X射线管的阴极。由于它对中子有较好的吸收能力,抗腐蚀性能好,强度高,因此常用来做核反应堆的控制棒,以减慢核子连锁反应的速率,同时抑制原子反应的"火焰"。
最近,英特尔及IBM分別用鉿的化合物来取代原先半导体上常用的二氧化硅绝缘材料,大幅减低其芯片厚度。研究机构分析,使用该技术可以让处理器制程在今后提高两个时代到22nm,让摩尔定律的失效期继续延后。
参考文献
- Gambogi, Joseph. (pdf). United States Geological Survey. [2008-10-27]. (原始内容存档 (PDF)于2008-12-17).
- Schemel, J. H. . ASTM International. 1977: 1–5. ISBN 978-0-8031-0505-8.
- Larsen, Edwin; Fernelius W., Conard; Quill, Laurence. . Ind. Eng. Chem. Anal. Ed. 1943, 15 (8): 512–515. doi:10.1021/i560120a015.
- van Arkel, A. E.; de Boer, J. H. (1924). "Die Trennung von Zirkonium und Hafnium durch Kristallisation ihrer Ammoniumdoppelfluoride (The separation of zirconium and hafnium by crystallization of the double ammonium fluorides)". Zeitschrift für anorganische und allgemeine Chemie (in German). 141: 284–288. doi:10.1002/zaac.19241410117.
- van Arkel, A. E.; de Boer, J. H. (1924). "Die Trennung des Zirkoniums von anderen Metallen, einschließlich Hafnium, durch fraktionierte Distillation (The separation of zirconium and hafnium by fractionated distillation)". Zeitschrift für anorganische und allgemeine Chemie (in German). 141: 289–296. doi:10.1002/zaac.19241410118.
- Hedrick, James B. "Hafnium Archived 2012-07-02 at WebCite" (pdf). United States Geological Survey. Retrieved 2008-09-10.
- Griffith, Robert F. . . The first production plants Bureau of Mines. 1952: 1162–1171 [2017-07-01]. (原始内容存档于2016-03-03).
- Gilbert, H. L.; Barr, M. M. . Journal of the Electrochemical Society. 1955, 102 (5): 243. doi:10.1149/1.2430037.
- Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). Lehrbuch der Anorganischen Chemie (in German) (91–100 ed.). Walter de Gruyter. pp. 1056–1057. ISBN 3-11-007511-3.
- van Arkel, A. E.; de Boer, J. H. (1925). "Darstellung von reinem Titanium-, Zirkonium-, Hafnium- und Thoriummetall (Production of pure titanium, zirconium, hafnium and Thorium metal)". Zeitschrift für anorganische und allgemeine Chemie (in German). 148: 345–350. doi:10.1002/zaac.19251480133.
- 北师大 等. 无机化学(第四版)下册. 高等教育出版社, 2003. ISBN 978-7-04-011583-3. pp 793
- Andrievskii, R. A.; Strel'nikova, N. S.; Poltoratskii, N. I.; Kharkhardin, E. D.; Smirnov, V. S. . Soviet Powder Metallurgy and Metal Ceramics. 1967, 6 (1): 65–67. ISSN 0038-5735. doi:10.1007/BF00773385.
- Hong, Qi-Jun; van de Walle, Axel. . Physical Review B. 2015, 92 (2). ISSN 1098-0121. doi:10.1103/PhysRevB.92.020104.
- 申泮文, 车云霞, 罗裕基 等. 无机化学丛书 第八卷 钛分族 钒分族 铬分族. 科学出版社, 1998. ISBN 7-03-005554-3
- Zherikova, K. V.; Morozova, N. B.; Kuratieva, N. V.; Baidina, I. A.; Igumenov, I. K. . Journal of Structural Chemistry. November 2005, 46 (6): 1039–1046. doi:10.1007/s10947-006-0239-2.
- 王长红, 杨声海, 陈永明 等. 电化学合成乙醇铪的参数优化、表征和热性能分析. 中国有色金属学报(英文版), 2017, 27 (3):694-700
外部連結
- 元素铪在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— {{LinkForElement|Hf| }}(英文)
- 元素铪在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素铪在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – {{LinkForElement|Hf| }}(英文)
