钫
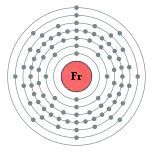
鍅(Francium)是一種化學元素,化學符號為Fr,原子序為87,曾被稱為 eka-caesium。鍅是一種放射性極高的金屬。它最穩定的同位素,鍅-223(在它出現於自然衰變鏈之前原本被稱為actinium K)的半衰期僅22分鐘。鍅的電負度僅高於銫,在天然元素中的含量僅高於砈。鍅的同位素會快速衰變成砈、鐳和氡。鍅的電子組態為[Rn] 7s1,因此該元素被歸類為鹼金屬。
塊體的鍅金屬從未被觀察到。根據元素週期表的同族元素特性規律,當足量的鍅聚集在一起形成一塊固體或液體(因鍅熔點低,室溫時可能為液態),它會是高活性金屬,然而獲取如此高活性的鍅是幾乎不可能的,因為鍅的半衰期短,其衰變放出的熱會立即使鍅氣化成蒸氣。
1939年[1],法國科學家馬格利特‧佩賴在法國(鍅的名字由此而來)從227Ac的衰變產物中發現了鍅元素。鍅是最後一個從自然界中發現,而非經過人工合成的元素。[註 1]鍅在實驗室以外極為罕見,它會痕量出現在鈾和釷礦石中,而在其中的同位素鍅-223則會不斷地形成與衰變。地殼中只有約20至30克的鍅存在。除了鍅-223和221以外,其他同位素都是在實驗室中製得。在實驗室中產生最大量的鍅元素為超過300,000個鍅原子的團簇。[2]
特性
鈁是所有自然元素中最不穩定的,其最穩定同位素鈁-223的半衰期也只有22分鐘。穩定性第二低的砹元素半衰期有8.5小時。[3]所有鈁同位素都會衰變為砹、鐳或氡。[3]鈁的穩定性比原子序106(𨭎)以下的所有人造元素都要低。[4]
鈁是一種鹼金屬,化學屬性與銫相近,[4]同樣只有一顆價電子。[5]如果成功製成,液態鈁在熔點的表面張力將為0.05092 N/m。[6]根據計算,鈁的熔點約為24 °C,沸點為677 °C。[7]但由於鈁既罕有又具放射性,所以這些數字並不一定準確。
萊納斯·鮑林估計鈁的電負性為0.7,當時與銫相同。[8]銫的電負性之後被修正為0.79,但因數據不足,不能同樣地修正鈁的電負性數字。[9]鈁的電離能比銫稍高。[10]
鈁會和多種銫鹽共同沉澱,如高氯酸鈁會和高氯酸銫共沉澱,從而分離出鈁。其他能共沉澱的銫鹽包括碘酸銫、苦味酸銫、酒石酸銫、氯鉑酸銫以及矽鎢酸銫。同樣可與鈁共沉澱的有矽鎢酸和高氯酸,而不需要任何鹼金屬載體。[11][12]幾乎所有鈁鹽都可溶於水。[13]
應用
鈁由於極為罕見、穩定性低,因此目前還沒有商業應用。[14][15][16][17]它在生物學[18]和原子結構等領域的研究中起到了作用。科學家曾提出用鈁來診斷各種癌症,[3]但這一用途並不現實。[15]
鈁可以被合成、捕捉和冷卻,而且原子結構簡單,因此它被用在一些光譜學實驗中,在能級和亞原子粒子間的耦合常數上提供了新的信息。[19]對鈁-210離子在激光捕捉下所發出的光譜的研究指出,鈁的實際原子能級符合量子理論的預測。[20]
歷史
1870年,化學家就開始猜想銫以下存在著一種尚未發現的鹼金屬,原子序為87。[3]當時人們稱其為「eka-銫」。[21]多個研究團隊嘗試發現並分離出這種新元素,在真正發現之前,至少出現了4次錯誤發現。
錯誤或不完整的發現
蘇聯化學家D. K.多布羅謝爾多夫(Dobroserdov)是第一位聲稱發現了鈁的科學家。1925年,他在一個鉀樣本中觀察到弱放射性,錯誤地認為這是87號元素所造成的。實際上放射性來自自然產生的鉀-40。[22]他而後發佈了一篇有關預測87號元素的屬性的論文,當中將其以他的國家俄羅斯(Russia)命名為Russium。[23]不久後,多布羅謝爾多夫開始專注於他在敖德薩理工學院的教學工作,而並沒有繼續研究這一元素。[22] 翌年,英國化學家傑拉爾德·德魯斯(Gerald J. F. Druce)和費德里克·羅林(Frederick H. Loring)分析了硫酸錳的X光片,[23]以為觀察到的光譜線來自於87號元素。他們發佈了這項發現,把該元素命名為Alkalinium,因為它是最重的鹼金屬(alkali metal)。[22]
1930年,美國阿拉巴馬州理工學院的弗雷德·艾利森(Fred Allison)在用磁光儀器研究銫榴石和鋰雲母後,聲稱發現了87號元素,並建議以他的家鄉佛吉尼亞州(Virginia)命名為Virginium,符號Vi或Vm。[23][24]然而在1934年,伯克利加州大學的H. G.麥佛森(H. G. MacPherson)證明艾利森的儀器是無效的,並且推翻了他的發現。[25]
1936年,羅馬尼亞物理學家霍里亞·胡盧貝伊(Horia Hulubei)與法國物理學家伊維特·哥舒瓦(Yvette Cauchois)也研究了銫榴石,使用的是高解析度X-光儀器。[22]他們觀察到幾條弱發射光譜線,以為它們來自87號元素。胡盧貝伊和哥舒瓦發佈了這項發現,並以胡盧貝伊的誕生地羅馬尼亞摩爾達維亞省(Moldavia)命名為Moldavium,符號為Ml。[23]1937年,美國物理學家F. H.赫士(F. H. Hirsh Jr.)對胡盧貝伊的研究手法進行了批判。赫士非常肯定87號元素不會在自然界中發現,並聲稱胡盧貝伊觀察到的其實是汞和鉍的X-射線光譜線。胡盧貝伊堅持自己的X-光儀器和實驗方法足夠準確,他的發現不可能是錯誤的。胡盧貝伊的導師,諾貝爾獎得主讓·佩蘭也支持他的發現。馬格利特·佩里在1939年確實發現鈁之後,一直都批評胡盧貝伊的研究,直到自己被承認為鈁的正式發現者為止。[22]
佩里的發現
1939年,法國巴黎居里研究所的馬格利特·佩里在純化錒-227的時候,發現了鈁元素。錒-227的衰變能量應該是220 keV,但佩里卻觀察到衰變能量低於80 keV的粒子。她認為這些異常的衰變活動源自尚未發現的一種衰變產物。這種產物在純化過程中已經被分離出去,而是在純錒-227樣本中自然產生的。經過一系列測試之後,她消除了這種未知同位素是釷、鐳、鉛、鉍和鉈的可能性。該產物具有鹼金屬的屬性(比如可以和銫鹽共沉澱等),佩里因此判斷這就是錒-227經α衰變所產生的87號元素。[21]
佩里把這一新同位素命名為錒-K(今天則稱鈁-223),[21]又在1946年提出正式命名Catium,因為她相信這種元素正離子(cation)的電正性是所有元素中最高的。佩里的其中一位導師伊雷娜·约里奥-居里反對這一命名,因為Catium一字更像是「貓元素」(cat),而非正離子。[21]佩里繼而建議用法國(France)來命名為Francium,也就是鈁的現名。國際純粹與應用化學聯合會在1949年接納了這一名稱。[3]鈁也成為了繼鎵之後第二個以法國命名的元素。鈁最初的符號為Fa,但不久後便改為Fr。[26]鈁是1925年錸被發現後,最後一個在自然界中發現的元素。[21]歐洲核子研究中心在1970年代至1980年代間進一步研究了鈁的結構。[27]
存量
自然
錒-227經α衰變之後,會產生鈁-223,因此鈁以痕量存在於鈾和釷的礦石中。[4]在一個鈾樣本中,估計每1×1018個鈾原子就有一個鈁原子。[15]根據計算,地球的地殼中,同一時間只有約30克鈁。[28]
合成
鈁可以通過以下核反應合成:
- 197Au + 18O → 210Fr + 5 n
這一過程可以產生鈁-209、210和211,[29]產物再由磁光阱分離出來。[30]氧束的能量會影響同位素的形成速率。實驗所用的金目標體必須在接近熔點的溫度下,而且表面必須完全沒有雜質。核反應會把鈁原子嵌入目標體的深處,原子再迅速移動到表面,以離子的形式釋放出來。靜電透鏡把鈁離子引導至一個釔金屬片的表面,這時鈁離子會變回中性原子。激光束和磁場再對原子進行冷卻和控制。原子在磁光阱中只會停留20秒左右,之後逃脫或衰變,但新的原子會不斷替代這些失去了的原子。這一過程使原子數量在1分鐘之內大約不變。首次進行這項實驗時,科學家捕捉了1000個鈁原子。在不斷改進後,實驗最終能夠捕捉超過30萬個鈁原子。[2]捕獲到的鈁原子處於鬆散氣體狀態,當數量足夠多的時候,鈁發出的螢光就可以在攝影機上留下影像。影像呈球體,直徑約為1毫米。這是鈁首次被人類直接看到。研究人員這時就可以準確地測量鈁所釋放及吸收的亮光,從而給出原子能級躍遷的實驗數據。初步結果表明,實驗數據與量子理論所預測的相吻合。
同位素
鈁共有34個同位素,原子量從199到232不等,[32]另有7種亞穩態同核異構體。[32]自然產生的只有鈁-223和鈁-221,其中鈁-221罕見得多。[33]
鈁-223是最穩定的同位素,半衰期為21.8分鐘。[32]再發現或合成半衰期更長的鈁同位素的可能性極低。[31]鈁-223是錒衰變系的第五個產物,是錒-227的子同位素。[17]鈁-223會再β衰變為鐳-223(衰變能量為1149 keV),另有0.006%的α衰變路徑,產物為砹-219(衰變能量為5.4 MeV)。[34]
鈁-221的半衰期為4.8分鐘。[32]它是錼衰變系的第九個產物,是錒-225的子同位素。[17]鈁-221會再α衰變成砹-217(衰變能量為6.457 MeV)。[32]
基態最不穩定的同位素是鈁-215,半衰期只有0.12 μs。它會α衰變為砹-211,能量為9.54 MeV。[32]其亞穩態同核異構體鈁-215m的穩定性則更低,半衰期只有3.5 ns。[35]
備註
- Some synthetic elements, like technetium and plutonium, have later been found in nature.
參考資料
- Perey, M. . Journal de Physique et le Radium. 1939-10-01, 10 (10): 435–438. ISSN 0368-3842. doi:10.1051/jphysrad:019390010010043500 (法语).
- Luis A. Orozco. . Chemical and Engineering News. 2003.
- Price, Andy. . 2004-12-20 [2012-02-19].
- 4. CRC. 2006: 12. ISBN 0-8493-0474-1.
- Winter, Mark. . Francium. The University of Sheffield. [2007-04-18].
- Kozhitov, L. V.; Kol'tsov, V. B.; Kol'tsov, A. V. . Inorganic Materials. 2003, 39 (11): 1138–1141. doi:10.1023/A:1027389223381.
- . Los Alamos National Laboratory. 2003-12-15 [2012-02-19].
- Pauling, Linus. Third. Cornell University Press. 1960: 93. ISBN 978-0-8014-0333-0.
- Allred, A. L. . J. Inorg. Nucl. Chem. 1961, 17 (3–4): 215–221. doi:10.1016/0022-1902(61)80142-5.
- Andreev, S.V.; Letokhov, V.S.; Mishin, V.I.,. . Physical Review Letters. 1987, 59 (12): 1274–76. Bibcode:1987PhRvL..59.1274A. PMID 10035190. doi:10.1103/PhysRevLett.59.1274.
- Hyde, E. K. . J. Am. Chem. Soc. 1952, 74 (16): 4181–4184. doi:10.1021/ja01136a066.
- E. N K. Hyde Radiochemistry of Francium,Subcommittee on Radiochemistry, National Academy of Sciences-National Research Council; available from the Office of Technical Services, Dept. of Commerce, 1960.
- Maddock, A. G. . Q. Rev., Chem. Soc. 1951, 3 (3): 270–314. doi:10.1039/QR9510500270.
- Winter, Mark. . Francium. The University of Sheffield. [2007-03-25].
- Emsley, John. . Oxford: Oxford University Press. 2001: 151–153. ISBN 0-19-850341-5.
- Gagnon, Steve. . Jefferson Science Associates, LLC. [2007-04-01].
- Considine, Glenn D. (编). . New York: Wiley-Interscience. 2005: 332. ISBN 0-471-61525-0.
- Haverlock, TJ; Mirzadeh, S; Moyer, BA. . J Am Chem Soc. 2003, 125 (5): 1126–7. PMID 12553788. doi:10.1021/ja0255251.
- Gomez, E; Orozco, L A, and Sprouse, G D. . Rep. Prog. Phys. 2005-11-07, 69 (1): 79–118. Bibcode:2006RPPh...69...79G. doi:10.1088/0034-4885/69/1/R02.
- Peterson, I. (PDF). Science News. 1996-05-11, 149 (19): 294 [2009-09-11]. doi:10.2307/3979560.
- Adloff, Jean-Pierre; Kaufman, George B. (2005-09-25). Francium (Atomic Number 87), the Last Discovered Natural Element 的存檔,存档日期2013-06-04.. The Chemical Educator 10 (5). Retrieved on 2007-03-26.
- Fontani, Marco. . . Lisbon: 1–8. 2005-09-10 [2007-04-08]. (原始内容存档于2006-02-24).
- Van der Krogt, Peter. . Elementymology & Elements Multidict. 2006-01-10 [2007-04-08].
- . TIME. 1932-02-15 [2007-04-01].
- MacPherson, H. G. . Physical Review (American Physical Society). 1934, 47 (4): 310–315. Bibcode:1935PhRv...47..310M. doi:10.1103/PhysRev.47.310.
- Grant, Julius. . . McGraw-Hill. 1969: 279–280. ISBN 0-07-024067-1.
- . Francium. State University of New York at Stony Brook. 2007-02-20 [2007-03-26]. (原始内容存档于2007-04-05).
- Winter, Mark. . Francium. The University of Sheffield. [2007-03-26].
- . Francium. State University of New York at Stony Brook. 2007-02-20 [2007-03-26]. (原始内容存档于2007-04-05).
- . Francium. State University of New York at Stony Brook. 2007-02-20 [2007-05-01]. (原始内容存档于2007-04-05).
- . 7. McGraw-Hill Professional. 2002: 493–494. ISBN 0-07-913665-6.
- Lide, David R. (编). 11. CRC. 2006: 180–181. ISBN 0-8493-0487-3.
- Considine, Glenn D. (编). . New York: Wiley-Interscience. 2005: 679. ISBN 0-471-61525-0.
- National Nuclear Data Center. . Brookhaven National Laboratory. 1990 [2007-04-04]. (原始内容存档于2006-10-31).
- National Nuclear Data Center. . Brookhaven National Laboratory. 2003 [2007-04-04]. (原始内容存档于2007-06-30).
外部連結
- 元素钫在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— {{LinkForElement|Francium| }}(英文)
- 元素钫在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素钫在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – {{LinkForElement|Francium| }}(英文)
- Francium at The Periodic Table of Videos (University of Nottingham)
- WebElements.com – Francium
- Stony Brook University Physics Dept.