铑
銠(英語:)(舊譯錴)是化學元素,化學符號Rh,原子序45。其為一種稀有、堅硬、抗腐蝕、在化學上較為惰性的銀白色過渡金屬元素。銠是一種惰性金屬,同時是鉑系元素的一員,為最為稀有和貴重的貴金屬之一。銠在自然界中只存在一種同位素103Rh。自然界中的銠通常以金屬態的形式與性質相近的金屬元素形成合金,偶以硫銥鉑銠礦或硫銠鉛礦等化合物形式存在。
| 外觀 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
金屬:銀白色 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 铑(Rhodium)·Rh·45 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 過渡金屬 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·週期·區 | 9 ·5·d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 102.90550 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | [氪] 4d8 5s1 2, 8, 18, 16, 1 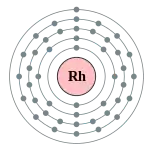 铑的电子層(2, 8, 18, 16, 1) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 發現 | 威廉·海德·伍拉斯顿(1804年) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分離 | 威廉·海德·伍拉斯頓 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 固體 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 12.41 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點時液體密度 | 10.7 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | 2237 K,1964 °C,3567 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 3968 K,3695 °C,6683 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | 26.59 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | 494 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | 24.98 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸氣壓
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | 6, 5, 4, 3, 2, 1[1], -1 (兩性) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | 2.28(鲍林标度) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:719.7 kJ·mol−1 第二:1740 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半徑 | 134 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | 142±7 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 面心立方晶格 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 順磁性[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電阻率 | (0 °C)43.3×10-9 Ω·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 150 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨脹係數 | (25 °C)8.2 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 聲速(細棒) | (20 °C)4700 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 楊氏模量 | 380 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 150 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 體積模量 | 275 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 6.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 維氏硬度 | 1246 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 1100 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 7440-16-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:铑的同位素
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
銠常和其他鉑系元素一起在鉑礦石或鎳礦石中被發現。它首先由英國化學家威廉·海德·伍拉斯頓於1803年發現,並以它的一種氯化合物的玫瑰色命名。
大約80%的生產出來的銠元素用於汽車的三向觸媒轉化器的觸媒。由於其對腐蝕和大部分高反應性化學物質的抗性,同時又因其極為稀有,銠常與鉑或鈀組成合金並應用於抗高溫及腐蝕的塗層。白金上常基於外觀上的考量而鍍有薄層的銠;英幣標準銀合金上鍍的銠則是為了增進其抗污能力。銠也可作為矽氧聚合物的交聯催化劑,使帶有氫負離子的矽氧聚合物和帶有末端乙烯基的矽氧聚合物混合後發生固化。[3]
銠可製成偵測核子反應爐的中子流量的偵測器。其他銠元素的應用包括:用於生產藥物前驅物的不對稱氫化反應、以及醋酸和農藥年年春的生產製程上。
性质
銠是一種堅硬耐用的金屬,具有很高的反射率,擁有比鉑更高的熔點和更低的密度。多數的酸無法侵蝕銠,其不溶於硝酸而微溶於王水。即使處於加熱狀態,銠也難以形成氧化物[4],僅在熔點時吸收大氣中的氧,然而一旦固化就又將氧釋出[5]。
化学性质
| 铑的氧化态 | |
|---|---|
| +0 | Rh 4(CO) 12 |
| +1 | RhCl(PH 3) 2 |
| +2 | Rh 2(O 2CCH 3) 4 |
| +3 | RhCl 3, Rh 2O 3 |
| +4 | RhF 4, RhO 2 |
| +5 | RhF 5, Sr 3LiRhO 6 |
| +6 | RhF 6 |
銠隸屬於9族元素,然而其最外層電子組態卻有異於同族的其他元素。這個不規則的現象也可在鄰近的鈮(41)、釕(44)、鈀(46)等元素身上觀察到。
銠最常見的氧化態為+3,但0~+6的氧化態皆有被發現[6]。
和釕、鋨元素不同,銠並不與氧形成具揮發性的化合物。目前已知的穩定氧化物包括:Rh
2O
3、RhO
2、RhO
2·xH
2O、Na
2RhO
3、Sr
3LiRhO
6以及Sr
3NaRhO
6[7]。銠幾乎所有可能的氧化態都能和鹵素形成化合物,例如:三氯化銠、四氟化銠、五氟化銠以及六氟化銠等,其中最廣為人知的就是威爾金森催化劑,即氯化三(三苯基膦)合銠(I)。這種催化劑主要用於氫甲醯化反應以及烯烴的氫化反應[8]。
发现
1803年,继威廉·海德·伍拉斯顿发现钯之后,他从产自南美洲的粗铂矿提取出铑。他使用王水,NaOH,氯化铵等物质,将钯转化为玫瑰红色沉淀。
来源
由镍生产的副产品获得。
銠為鉑礦中的的稀少成分,產量純粹取決有多少鉑礦開採出來,開採的鉑礦越多,從中得到的銠雜質也越多。若市場需求大於供給銠的價格就會高漲,因只為增加銠供給而採更多的鉑礦不符合經濟效益。[11]
用途
用作高科技仪器的防磨涂料和催化剂、铑铂合金用于生产热电偶。也用于镀在车前灯反射镜、电话中继器、钢笔尖、内燃機車輛的觸媒轉換器及白金首饰等。威爾金森催化劑是一種铑的配合物,可用于烯烃的氢化还原。
在核反应中用含铑的探测仪测量中子流水平。
參考文獻
- . OpenMOPAC.net. [2007-12-10]. (原始内容存档于2009-08-06).
- Magnetic susceptibility of the elements and inorganic compounds 的存檔,存档日期2011-03-03., in Handbook of Chemistry and Physics 81st edition, CRC press.
- Armin Fehn and Juergen Weidinger, Wacker Chemie AG, US patent US7129309B2
- Cramer, Stephen D.; Covino, Jr., Bernard S. (编). . Materials Park, OH: ASM International. 1990: 393–396. ISBN 978-0-87170-707-9.
- Emsley, John. (Hardcover, First Edition). Oxford University Press. 2001: 363. ISBN 978-0-19-850340-8.
- Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils. 91–100. Walter de Gruyter. 1985: 1056–1057. ISBN 978-3-11-007511-3.
- Reisner, B. A.; Stacy, A. M. . Journal of the American Chemical Society. 1998, 120 (37): 9682–9989. doi:10.1021/ja974231q.
- Osborn, J. A.; Jardine, F. H.; Young, J. F.; Wilkinson, G. . Journal of the Chemical Society A. 1966: 1711–1732. doi:10.1039/J19660001711.
- Griffith, W. P. The Rarer Platinum Metals, John Wiley and Sons: New York, 1976, p. 313.
- Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik, , Nuclear Physics A, 2003, 729: 3–128 [2019-07-04], Bibcode:2003NuPhA.729....3A, doi:10.1016/j.nuclphysa.2003.11.001, (原始内容存档于2015-04-02)
- 看得到的化學,Theodore Gray著,大是文化 ISBN 978-986652667-1
外部連結
- 元素铑在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— {{LinkForElement|銠| }}(英文)
- 元素铑在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素铑在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – {{LinkForElement|銠| }}(英文)
