鑪
鑪(Rutherfordium)是一種化學元素,符號為Rf,原子序為104。鑪是為紀念紐西蘭物理學家欧内斯特·卢瑟福而以他命名的。鑪是一種人工合成的放射性元素,不出現在自然界中,但可以在實驗室內產生。其最穩定的已知同位素為267Rf,半衰期約為1.3小時。
在元素週期表中,鑪位於d區塊,是第一個錒系後元素。鑪屬於第7週期、4族。化學實驗已證實,鑪是比同為4族的鉿較重的化學同系物。人們對鑪的化學特性瞭解不全。鑪與其他的4族元素相似,不過某些計算指出,由於相對論性效應,它可能會具有很不同的化學屬性。
位於前蘇聯和美國加州的實驗室在1960年代分別製造出少量的鑪。由於雙方發現鑪的先後次序不清,因此蘇聯和美國科學家們對其命名產生了爭議;直到1997年國際純化學和應用化學聯合會才將鑪作為該元素的正式名稱。
歷史
發現
位於杜布納(當時位於前蘇聯)的聯合核研究所於1964年宣佈首次發現鑪。研究人員以氖-22離子撞擊鈈-242目標,把產物與四氯化鋯(ZrCl4)反應後將其轉變為氯化物,再用溫度梯度色譜法把鑪從產物中分離出來。該團隊在一種具揮發性的的氯化物中探測到自發裂變事件,該氯化物具有類似於鉿的較重同系物的化學屬性。其半衰期數值最初並沒有被準確量度,但後來的計算則指出,衰變產物最可能為鑪-259:[5]
- 242
94Pu + 22
10Ne → 264−x
104Rf → 264−x
104RfCl4
1969年,美國加州大學伯克利分校以碳-12離子撞擊鉲,確定性地合成了鑪,並測量了257Rf 的α衰變:[6]
- 249
98Cf + 12
6C → 257
104Rf + 4 n
在美國進行的實驗於1973年得到獨立證實,其中通過觀測257Rf衰變產物——鍩-253——的K-α X光,確實了鑪為母衰變體。[7]
命名爭議
俄方科學家建議使用Kurchatovium作為該新元素命名,而美方科學家則建議使用Rutherfordium。[8]1992年,IUPAC/IUPAP超鐨元素工作組(TWG)評審了發現報告後,認為雙方是同時合成了第104號元素的,所以雙方應該共同享有這份名譽。[5]
美國的團隊其後回復了TWG,並稱TWG過分重視杜布納團隊的研究結果。他們也指出,俄方團隊曾在過去20年以內多次修改其報告細節,俄方對此沒有否認。他們還強調,TWG過於看重俄方團隊所進行的化學實驗,並指責TWG的委員會成員缺乏足夠的資歷。TWG隨後回應,稱已經審視過美方提出的各項意見,並認為沒有理由撤回先前有關發現順序的結論。[9]IUPAC最終使用了美國團隊所提出的名稱(Rutherfordium),這可能反映了其實際改變了決定。[10]
蘇聯的團隊稱其首次探測到該新元素,因此建議將其命名為Kurchatovium(Ku)以紀念伊格爾·庫爾恰托夫,其曾經領導過蘇聯原子彈計劃。東方集團國家的教科書都使用Kurchatovium作為該元素的正式命名,而中文則譯為「」[11]。美國的團隊則提議用Rutherfordium(Rf)為新元素的命名,以紀念原子核物理學之父歐内斯特·盧瑟福。
由於國際上對104號、105號元素名稱存在較大分歧,1977年8月國際純粹與應用物理學聯合會(IUPAC)正式宣佈100號以後元素停止使用人名命名,而使用臨時系統命名,譬如104號元素為Unnilquadium(Unq)(該名稱源自數字1、0和4的拉丁文寫法)。但由於應用不便,1994年IUPAC無機化學命名委員會又提出仍以人名命名,同時建議使用Dubnium(105號元素的現名,名稱源自杜布納,Dubna)作為104號元素的當時的名稱,因為Rutherfordium已被建議作為106號元素的名稱,而IUPAC也認為應該承認杜布納團隊對此領域研究的貢獻。然而,這時104至107號元素的名稱都具有爭議。1997年,有關的團隊解決了紛爭,并於同年8月27日IUPAC正式對101至109號元素重新英文定名,最終采用了現名Rutherfordium,Dubnium一名則成為了105號元素的名稱。[10]
隨後,全國科學技術名詞化學名詞審定委員會也據此於1998年7月8日公佈了101至109號元素重新审定的中文命名。其中104号元素Rutherfordium中文名曾定為「鑪」(音同「盧」),現根據IUPAC的決定,仍予以採用;105號元素Dubnium定為「𨧀」(音同「杜」)。自此,101至105號元素被正式定名,也彌補了1998年之前106號以后的元素一直無中文名称的遺憾,同時海峽兩岸化學家也已取得共識,可望在兩岸共同使用。[12][13]
核合成
鑪等超重元素的合成方法是將兩種較輕的元素通過粒子加速器相互高速撞擊,並以此產生核聚變反應。多數鑪同位素都可以用這種方法合成,但某些較重的同位素則目前只在原子序更高的元素的衰變產物當中發現。[14]
根據所用能量的高低,核合成分為「熱」和「冷」兩類。在熱核聚變反應中,低質量、高能的發射體朝着高質量目標(錒系元素)加速,產生處於高激發能的複核(約40至50 MeV),再裂變或蒸發出3至5顆中子。[14]在冷核聚變反應中,聚變所產生的複核有着低激發能(約10至20 MeV),因此這些產物的裂變可能性較低。複核冷卻至基態時,會只射出1到2顆中子,因此產物的含中子量更高。[15]冷核聚變一詞在此指的不是在室溫下發生的核聚變反應(見冷核聚變)。[16]
熱核聚變
位於杜布納的研究團隊在1964年首次嘗試合成鑪,所用的熱核聚變反應將氖-22發射體撞擊鈈-242目標[5]:
- 242
94Pu + 22
10Ne → 264-x
104Rf + x n (x=3,5).
於首次研究中,他們探測到兩次半衰期分別為0.3秒和8秒的自發裂變事件。前者之後被撤回,而後者則源自259Rf同位素。[5]1966年,該團隊重復進行了這條反應,並對具揮發性的氯化物產物進行了化學研究。他們辨認出一種揮發性氯化物,其屬性與鉿的較重化學同系物相似,並以自發裂變快速衰變。這是產生了RfCl4的有力證據。儘管其半衰期沒有被準確地測量出來,但是之後的證據指出產物最有可能是259Rf。團隊在接下來的幾年之內多次重復進行實驗,並於1971年把該同位素的自發裂變半衰期確定為4.5秒。[5]
1969年,以阿伯特·吉奧索為首,位於加州大學的團隊嘗試證實杜布納團隊所公佈的結果。在一次鋦-248和氧-16之間的反應中,他們未能證實杜布納團隊的結果,但卻探測到260Rf的自發裂變,其半衰期只有10至30 ms:
- 248
96Cm + 16
8O → 260
104Rf + 4 n .
1970年,美國團隊又再次研究了這條反應,但這次使用氧-18作為發射體,並探測到261Rf的自發裂變,半衰期長達65秒(之後修正為75秒)。[17][18]之後在加州勞倫斯伯克利國家實驗室進行的實驗得出一種短半衰期的262Rf同核異構體(其進行自發裂變,半衰期為47 ms)[19]及長半衰期的自發裂變事件,後者不確定地指向263Rf。[20]
吉奧索的團隊也研究了鉲-249與碳-13之間的反應,並合成了短半衰期的258Rf(其在11毫秒後進行自發裂變):[6]
- 249
98Cf + 13
6C → 258
104Rf + 4 n .
在轉用碳-12之後,他們更首次觀測到257Rf的α衰變。[6]
杜布納的團隊於1977首次研究錇-249和氮-14之間的反應,並於1985年證實產生了260Rf同位素,該同位素在28毫秒之後進行自發裂變:[5]
- 249
97Bk + 14
7N → 260
104Rf + 3 n .
1996年,勞倫斯伯克利國家實驗室在進行鈈-244和氖-22的核聚變反應時,觀測到了同位素262Rf:
- 244
94Pu + 22
10Ne → 266-x
104Rf + x n (x=4, 5).
研究團隊將半衰期確定為2.1秒,而不是先前報告中的47毫秒,這意味著兩個半衰期值可能是源自262Rf的兩種同核異構體的。[21]杜布納的團隊也研究了該反應,並於2000年觀測到261Rf的α衰變及261mRf的自發裂變。[22]
杜布納團隊於2000年首次公佈了使用鈾目標體的熱核聚變反應:
- 238
92U + 26
12Mg → 264-x
104Rf + x n (x = 3, 4, 5, 6).
他們觀測到260Rf和259Rf的衰變,之後又觀測到259Rf的衰變。在一系列利用鈾目標體的實驗中,勞倫斯伯克利國家實驗室的團隊於2006年探測到了261Rf。[22][23][24]
冷核聚變
首次合成鑪的冷核聚變反應是於1974年在杜布納進行的,反應將鈦-50射向鉛-208同位素目標:
- 208
82Pb + 50
22Ti → 258-x
104Rf + x n (x = 1, 2, 3).
測量到的自發裂變事件源自256Rf,[25]而其後在重離子研究所(GSI)進行的實驗則測量了257Rf和255Rf的衰變屬性。[26][27]
1974年,杜布納的研究人員研究了鉛-207和鈦-50之間的反應,並產生了255Rf。[28]1994年重離子研究所的一項研究使用鉛-206同位素,並探測到255Rf和254Rf。同年轉用鉛-204後則探測到253Rf。[27]
衰變
大部分質量數低於262的同位素都會出現於原子序更高的元素的衰變產物中,這能夠使之前探測的屬性有更準確的數值。較重的鑪同位素只出現在更重元素的衰變產物中。比如,自2004年起,在鐽-279衰變鏈中多次觀測到有通過α衰變形成267Rf的事件[29]:
- 279
110Ds → 275
108Hs + α → 271
106Sg + α → 267
104Rf + α.
這又繼續進行自發裂變,半衰期約為1.3小時。[29][30][31]
伯爾尼大學於1999年對𨧀-263同位素的合成進行了研究,並發現了符合通過電子捕獲形成263Rf的事件。產物中的鑪被分離出來,期間觀測到的有長半衰期(15分鐘)的自發裂變事件,以及半衰期大約為10分鐘的α衰變。[20]2010年有關Fl-285衰變鏈的報告中顯示了5個連續的α衰變,在產生265Rf之後,再進行自發裂變,半衰期為152秒。[4]
2004年進行的實驗初步顯示,在镆的衰變鏈中存在一種質量更高的同位素,268Rf[32]:
- 288
115Mc → 284
113Nh + α → 280
111Rg + α → 276
109Mt + α → 272
107Bh + α → 268
105Db + α ? → 268
104Rf + ν
e .
不過衰變鏈的最後一個步驟仍待確認。在5個α衰變事件產生𨧀-268之後,研究人員又觀測到了長半衰期的自發裂變事件。目前未知這些事件是否來自268Db 的直接自發裂變,還是268Db進行長半衰期的電子捕獲而產生268Rf。如果後者在產生後進行短半衰期的衰變,那麼這兩種情況是無法分辨的。[33]假設沒有探測到268Db的電子捕獲,則這些自發裂變事件就可能源自268Rf,那麼這個同位素的半衰期就不得而知了。[32][34]
根據2007年一項有關合成Nh的報告,同位素282113進行類似的衰變,並形成266Db,其再進行自發裂變,半衰期為22分鐘。假設沒有探測到266Db的電子捕獲,則這些自發裂變事件就可能源自266Rf,那麼這個同位素的半衰期就不得而知了。[35][36]
同位素
| 同位素 | 半衰期[3] | 衰變方式[3] | 發現年份 | 所用反應 |
|---|---|---|---|---|
| 253Rf | 48 μs | α, SF | 1994年 | 204Pb(50Ti,n)[27] |
| 254Rf | 23 μs | SF | 1994年 | 206Pb(50Ti,2n)[27] |
| 255Rf | 2.3 s | ε?, α, SF | 1974年 | 207Pb(50Ti,2n)[28] |
| 256Rf | 6.4 ms | α, SF | 1974年 | 208Pb(50Ti,2n)[28] |
| 257Rf | 4.7 s | ε, α, SF | 1969年 | 249Cf(12C,4n)[6] |
| 257mRf | 4.1 s | ε, α, SF | 1969年 | 249Cf(12C,4n)[6] |
| 258Rf | 14.7 ms | α, SF | 1969年 | 249Cf(13C,4n)[6] |
| 259Rf | 3.2 s | α, SF | 1969年 | 249Cf(13C,3n)[6] |
| 259mRf | 2.5 s | ε | 1969年 | 249Cf(13C,3n)[6] |
| 260Rf | 21 ms | α, SF | 1969年 | 248Cm(16O,4n)[5] |
| 261Rf | 78 s | α, SF | 1970年 | 248Cm(18O,5n)[17] |
| 261mRf | 4 s | ε, α, SF | 2001年 | 244Pu(22Ne,5n)[37] |
| 262Rf | 2.3 s | α, SF | 1996年 | 244Pu(22Ne,4n)[21] |
| 263Rf | 15 min | α, SF | 1999年 | 263Db(e− ,ν e )[20] |
| 263mRf ? | 8 s | α, SF | 1999年 | 263Db(e− ,ν e )[20] |
| 264Rf | 1? h | α ? | 未知 | — |
| 265Rf | 2.5 min | SF | 2010年 | 269Sg(—,α)[4] |
| 266Rf | 10 h ? | α, SF ? | 2007年? | 266Db(e− ,ν e )?[35] |
| 267Rf | 1.3 h | SF | 2004年 | 271Sg(—,α)[29] |
| 268Rf | 6 h ? | α, SF ? | 2004年? | 268Db(e− ,ν e )?[32] |
鑪沒有穩定或自然產生的同位素。鑪的一些同位素已在實驗室中成功合成,所用方法有兩種:高速撞擊兩種原子核以產生核聚變,或製造出更高的元素並觀測其衰變產物。目前已知的同位素共有15種,質量數從253到268不等(264除外),大部分通過自發裂變進行衰變。[3]
半衰期
較輕的鑪同位素一般具有較短的半衰期:253Rf和254Rf的為50 μs。256Rf、258Rf和260Rf更為穩定,半衰期在10 ms左右;255Rf、257Rf、259Rf和262Rf的半衰期介乎1至5秒,而261Rf、265Rf和263Rf則較穩定,半衰期分別為1、1.5和10分鐘。最重的同位素最為穩定,其中267Rf的約為1.3小時。[3]
低質量的同位素有兩種生成方式:兩種原子直接經過核聚變產生,或作為更重元素的衰變產物。通過直接核聚變產生的最重的同位素為262Rf,比其質量更高的同位素則只在其他元素的衰變產物中出現,其中已證實的只有267Rf一種。同位素266Rf和268Rf也曾被發現於衰變產物中,半衰期可能分別長達10小時和6小時,但它們是通過系統化研究間接探測的。雖然264Rf仍待發現,但預計半衰期長達1小時。[3]在被發現之前,265Rf曾被預測擁有13小時的長半衰期,[3]但實際只有2.5分鐘。[4]
1999年,位於美國加州伯克利的科學家宣佈成功合成3顆293118原子。[38]他們稱這些原子核先後射出7顆α粒子,並形成265Rf原子核,但在2001年撤回了這一項結果。[39]
同核異構體

最初有關合成263Rf的研究指出,該核素主要是以自發裂變方式衰變的,半衰期為10至20分鐘。近期對𨭆同位素的研究也同時產生了263Rf原子,其半衰期較短,約為8秒。這兩種衰變方式意味著存在兩種不同的同核異構體,但由於觀測到的事件太少,未能確定同核異構體的屬性。[20]
在利用244Pu(22Ne,5n)261Rf這條反應研究鑪同位素的合成時,人們發現反應的產物進行了8.28 MeV的α衰變,半衰期為78秒。之後重離子研究所在研究鎶和𨭆的合成時,卻得到了不同的數據:衰變鏈中的261Rf進行8.52 MeV的α衰變,半衰期為4秒。後來的結果指出,該核素主要進行裂變。這些矛盾使人們對鎶的合成產生了懷疑。第一種同核異構體為261aRf(或直接記為261Rf),第二種為261bRf(或記為261mRf)。不過,一般認為前者屬於高自旋基態,而後者則屬於低自旋亞穩態。[37]同核異構體261bRf的發現及確認最終使鎶的發現在1996年得到了肯定。[41]
對利用208Pb(50Ti,n)257Rf這條反應的詳細光譜分析確認了257Rf的一種同核異能態。分析發現257gRf有著具15條α譜線的複雜光譜,並算出了兩種同核異構體的能級結構圖。[42]類似的同核異構體也被發現存在於256Rf中。[43]
預測的屬性
化學屬性
鑪是第一個錒系後元素,也是第二個6d系過渡金屬。對鑪以及其離子態的電離能、原子半徑等屬性的計算指出,鑪與鉿相似,但與鉛相異。人們依此推斷,鑪的基本屬性會和其他的4族元素(鈦、鋯及鉿)相似。[44][20]它的一些屬性是通過氣態及水溶化學實驗而取得的。同族前兩個元素的唯一穩定氧化態為+4,因此鑪也應會有+4氧化態。[44]另外,鑪也預計會產生較不穩定的+3態。[2]
對鑪化學屬性的計算指出,相對論性效應足以使p軌域的能級比d軌域的要低,價電子排布將為6d1 7s2 7p1或甚至為7s2 7p2,因此與鉿相比,鉛會和鑪更為相似。然而通過更準確的計算及對鑪化合物的化學研究指出,鑪的屬性與4族元素的相符。[44][2]
與鋯和鉿相似,鑪預計會形成一種非常穩定的高熔點氧化物RfO2。它會和鹵素反應形成四鹵化物RfX4,在與水接觸後會水解成氧鹵化物RfOX2。這些四鹵化物都是具揮發性的固體,在呈氣態時為單體四面體分子。[44]
在水溶狀態時,Rf4+離子的水解程度較Ti4+低,但與鋯和鉿的相約。鑪的鹵化物與鹵素離子混合時,會促進形成絡離子。使用氯離子和溴離子時,反應會產生RfCl2−
6和RfBr2−
6。鋯和鉿會形成七氟及八氟絡合物,因此更大的鑪離子應該可以形成RfF2−
6、RfF2−
7和RfF4−
8。[44]
實驗化學
| 公式 | 名稱 |
|---|---|
| RfCl4 | 四氯化鑪 |
| RfBr4 | 四溴化鑪 |
| RfOCl2 | 氯氧化鑪 |
| [RfCl6]2− | 六氯合鑪(IV)酸阴离子 |
| [RfF6]2− | 六氟合鑪(IV)酸阴离子 |
| K2[RfCl6] | 六氯合鑪(IV)酸钾 |
氣態
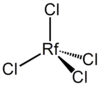
早期對鑪的化學研究主要集中於使用氣態熱力色譜法及對相對沉積溫度吸附曲線的測量。最早在這一方面的研究是由杜布納進行的,他們希望以此確認鑪的發現。這些實驗使用了261mRf同位素。實驗假設鑪是第一個6d系元素,因此會形成四氯化物。[44][33][46]四氯化鑪比四氯化鉿(HfCl4)揮發性更高,因為其中的化學鍵更似共價鍵。[2]
一系列的實驗已經證實,鑪具有典型的4族元素特性,會形成RfCl4和RfBr4,以及一種氯氧化物RfOCl2。在使用固態而非氣態的氯化鉀時,所產生的RfCl
4的揮發性降低了。這表示產生了不揮發的K
2RfCl
6混合鹽。[44][20][47]
水溶態
鑪的電子排布預計為[Rn]5f14 6d2 7s2,因此會具有鉿的4族同系物的屬性。它會在強酸中形成Rf4+水合離子,並在氫氯酸、氫溴酸或氫氟酸中形成絡合物。[44]
至今最具確定性的鑪水溶化學研究是由日本原子能研究所進行的,使用的為261mRf放射性同位素。實驗分別用鑪、鉿、鋯及釷在氫氯酸中進行提取,並證實了鑪不具備錒系元素的特性。在和其同系物對比之下,鑪能夠肯定地歸為4族元素。在氯離子溶液中,鑪會形成六氯化鑪絡離子,這與鉿和鋯相似。[44][48]
- 261mRf4+ + 6 Cl−
→ [261mRfCl6]2-
在氫氟酸中的情況類似。鑪對氟離子的親和力較弱,並會形成六氟化鑪絡離子,而鉿和鋯則在同樣的氟離子濃度下產生了七氟甚至八氟絡離子:[44]
- 261mRf4+ + 6 F−
→ [261mRfF6]2-
參考資料
- Chemical Data. Rutherfordium - Rf, Royal Chemical Society
- Haire, Richard G. . Morss; Edelstein, Norman M.; Fuger, Jean (编). 3rd. Dordrecht, The Netherlands: Springer Science+Business Media. 2006. ISBN 1-4020-3555-1.
- Sonzogni, Alejandro. . National Nuclear Data Center: Brookhaven National Laboratory. [2008-06-06]. (原始内容存档于2007-07-23).
- Ellison, P.; Gregorich, K.; Berryman, J.; Bleuel, D.; Clark, R.; Dragojević, I.; Dvorak, J.; Fallon, P.; Fineman-Sotomayor, C. . Physical Review Letters. 2010, 105. Bibcode:2010PhRvL.105r2701E. doi:10.1103/PhysRevLett.105.182701.
- Barber, R. C.; Greenwood, N. N.; Hrynkiewicz, A. Z.; Jeannin, Y. P.; Lefort, M.; Sakai, M.; Ulehla, I.; Wapstra, A. P.; Wilkinson, D. H. . Pure and Applied Chemistry. 1993, 65 (8): 1757–1814. doi:10.1351/pac199365081757.
- Ghiorso, A.; Nurmia, M.; Harris, J.; Eskola, K.; Eskola, P. . Physical Review Letters. 1969, 22 (24): 1317–1320. Bibcode:1969PhRvL..22.1317G. doi:10.1103/PhysRevLett.22.1317.
- Bemis, C. E.; 等. . Physical Review Letters. 1973, 31 (10): 647–650. Bibcode:1973PhRvL..31..647B. doi:10.1103/PhysRevLett.31.647.
- . Rsc.org. [2010-09-04]. (原始内容存档于2011-04-08).
- Ghiorso, A.; Seaborg, G. T.; Organessian, Yu. Ts.; Zvara, I.; Armbruster, P.; Hessberger, F. P.; Hofmann, S.; Leino, M.; Munzenberg, G.; Reisdorf W.; Schmidt, K.-H. . Pure and Applied Chemistry. 1993, 65 (8): 1815–1824. doi:10.1351/pac199365081815.
- . Pure and Applied Chemistry. 1997, 69 (12): 2471–2474. doi:10.1351/pac199769122471.
- . 香港教育城. [2013-02-23]. (原始内容存档于2016-03-05).
- 刘路沙. . 光明网. 光明日报. [2020-11-10].
- 贵州地勘局情报室摘于《中国地质矿产报》(1998年8月13日). . 貴州地質. 1998, 15: 298–298 [2020-11-10].
- Barber, Robert C.; Gäggeler, Heinz W.; Karol, Paul J.; Nakahara, Hiromichi; Vardaci, Emanuele; Vogt, Erich. . Pure and Applied Chemistry. 2009, 81 (7): 1331. doi:10.1351/PAC-REP-08-03-05.
- Armbruster, Peter & Munzenberg, Gottfried. . Scientific American. 1989, 34: 36–42.
- Martin Fleischmann. . Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 10 April 1989, 261 (2): 301–308. doi:10.1016/0022-0728(89)80006-3.
- Ghiorso, A.; Nurmia, M.; Eskola, K.; Eskola P. . Physics Letters B. 1970, 32 (2): 95–98. Bibcode:1970PhLB...32...95G. doi:10.1016/0370-2693(70)90595-2.
- Sylwester, E. R.; 等. . Radiochimica Acta. 2000, 88 (12_2000): 837. doi:10.1524/ract.2000.88.12.837.
- Somerville, L. P.; M. J. Nurmia, J. M. Nitschke, and A. Ghiorso E. K. Hulet and R. W. Lougheed. . Physical Review C. 1985, 31 (5): 1801–1815. Bibcode:1985PhRvC..31.1801S. doi:10.1103/PhysRevC.31.1801.
- Kratz, J. V.; 等. (PDF). Radiochim. Acta. 2003, 91 (1-2003): 59–62. doi:10.1524/ract.91.1.59.19010. (原始内容 (PDF)存档于2009-02-25).
- Lane, M. R.; 等. . Physical Review C. 1996, 53 (6): 2893–2899. Bibcode:1996PhRvC..53.2893L. doi:10.1103/PhysRevC.53.2893.
- Lazarev, Yu.; 等. . Physical Review C. 2000, 62 (6). Bibcode:2000PhRvC..62f4307L. doi:10.1103/PhysRevC.62.064307.
- Gregorich, K.E.; 等. (PDF). LBNL annual report. 2005 [2008-02-29]. (原始内容存档 (PDF)于2008-02-29).
- Gates, J. M.; 等. . Physical Review C. 2008, 77 (3). Bibcode:2008PhRvC..77c4603G. doi:10.1103/PhysRevC.77.034603.
- Oganessian, Yu. Ts.; Demin, A. G.; Il'inov, A. S.; Tret'yakova, S. P.; Pleve, A. A.; Penionzhkevich, Yu. É.; Ivanov M. P.; Tret'yakov, Yu. P. . Nuclear Physics A. 1975, 38 (6): 492–501. Bibcode:1975NuPhA.239..157O. doi:10.1016/0375-9474(75)91140-9.
- Heßberger, F. P.; 等. . Zeitschrift für Physik A. 1985, 321 (2): 317. Bibcode:1985ZPhyA.321..317H. doi:10.1007/BF01493453.
- Heßberger, F. P.; Hofmann, S.; Ninov, V.; Armbruster, P.; Folger, H.; Münzenberg, G.; Schött, H. J.; Popeko, A. K.; Yeremin, A. V. ; Andreyev, A. N.; Saro, S. . Zeitschrift für Physik A. 1997, 359 (4): 415. Bibcode:1997ZPhyA.359..415A. doi:10.1007/s002180050422.
- Heßberger, F.P.; Hofmann, S.; Ackermann, D.; Ninov, V.; Leino, M.; Münzenberg, G.; Saro, S.; Lavrentev, A.; Popeko, A.G.; Yeremin, A.V.; Stodel, Ch. . European Physical Journal A. 2001, 12 (1): 57–67. Bibcode:2001EPJA...12...57H. doi:10.1007/s100500170039.
- Hofmann, S. 764. Springer. 2009: 203–252. doi:10.1007/978-3-540-85839-3_6.
- Oganessian, Yu. Ts.; 等. . Physical Review C. 2004, 70 (6). Bibcode:2004PhRvC..70f4609O. doi:10.1103/PhysRevC.70.064609.
- Oganessian, Yuri. . Journal of Physics G: Nuclear and Particle Physics. 2007, 34 (4): R165. Bibcode:2007JPhG...34..165O. doi:10.1088/0954-3899/34/4/R01.
- . Cdsweb.cern.ch. [2010-09-19].
- Oganessian, Yury Ts; Dmitriev, Sergey N. . Russian Chemical Reviews. 2009, 78 (12): 1077. Bibcode:2009RuCRv..78.1077O. doi:10.1070/RC2009v078n12ABEH004096.
- Krebs, Robert E. . Greenwood Publishing Group. 2006: 344 [2010-09-19]. ISBN 978-0-313-33438-2.
- Oganessian, Yu. Ts.; 等. . Physical Review C. 2007, 76 (1). Bibcode:2007PhRvC..76a1601O. doi:10.1103/PhysRevC.76.011601.
- Hofmann, S. 764. Springer. 2009: 229. doi:10.1007/978-3-540-85839-3_6.
- Dressler, R. and Türler, A. (PDF). PSI Annual Report 2001. [2008-01-29]. (原始内容 (PDF)存档于2011-07-07).
- Ninov, Viktor; et al.. . Physical Review Letters. 1999, 83 (6): 1104–1107. Bibcode:1999PhRvL..83.1104N. doi:10.1103/PhysRevLett.83.1104.
- Public Affairs Department. . Berkeley Lab. 2001-07-21 [2008-01-18]. (原始内容存档于2008年1月29日).
- Streicher, B.; 等. . The European Physical Journal A. 2010, 45 (3): 275. Bibcode:2010EPJA...45..275S. doi:10.1140/epja/i2010-11005-2.
- Barber, R.C; Gaeggeler, H.W; Karol, P.J; Nakahara, H; Vardaci, E; Vogt, E. (IUPAC Technical Report). Pure Appl. Chem. 2009, 81 (7): 1331 [2013-02-18]. doi:10.1351/PAC-REP-08-03-05. (原始内容存档 (PDF)于2012-03-13).
- Qian, J.; 等. . Physical Review C. 2009, 79 (6): 064319. Bibcode:2009PhRvC..79f4319Q. doi:10.1103/PhysRevC.79.064319.
- Jeppesen, H. B.; 等. . Physical Review C. 2009, 79 (3): 031303(R). Bibcode:2009PhRvC..79c1303J. doi:10.1103/PhysRevC.79.031303.
- Kratz, J. V. (PDF). Pure and Applied Chemistry. 2003, 75 (1): 103. doi:10.1351/pac200375010103. (原始内容 (PDF)存档于2011-07-26).
- Östlin, A.; Vitos, L. . Physical Review B. 2011, 84 (11). Bibcode:2011PhRvB..84k3104O. doi:10.1103/PhysRevB.84.113104.
- Türler, A; Buklanov, G.V.; Eichler, B.; Gäggeler, H.W.; Grantz, M.; Hübener, S.; Jost, D.T.; Lebedev, V.Ya.; Piguet, D. . Journal of Alloys and Compounds. 1998,. 271–273: 287. doi:10.1016/S0925-8388(98)00072-3.
- Gäggeler, Heinz W. (PDF). 2007-11-05 [2010-03-30]. (原始内容 (PDF)存档于2012-02-20).
- Nagame, Y.; 等. (PDF). Radiochimica Acta. 2005, 93 (9-10_2005): 519. doi:10.1524/ract.2005.93.9-10.519. (原始内容 (PDF)存档于2008-05-28).
外部連結
- 元素鑪在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— {{LinkForElement|Rutherfordium| }}(英文)
- 元素鑪在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素鑪在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – {{LinkForElement|Rutherfordium| }}(英文)