稀有气体
、鈍氣、,是指在元素週期表中同屬第18族(舊稱ⅧA族)的元素。它们性质相似,在常温常压下都是无色无味的单原子气体,很难进行化学反应。天然存在的稀有气体有六种,即氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)和具放射性的氡(Rn)。而人工合成的(Og)原子核非常不稳定,半衰期極短。根据元素周期律,除了氖的反應活性最低外,其餘惰性氣體的反應活性隨著原子序的增大而漸高,因此估计應比氡更活泼,不過,理论计算显示,它可能会非常活泼,不一定能称为稀有气体[1]。根據預測,和同為第七週期的碳族元素鈇(Fl)反而能表現出稀有氣體的性質[2]。
稀有气体的特性可以用现代的原子结构理论来解释:它们的最外电子层的电子已「满」(即已达成八隅体状态),所以它们非常稳定,极少进行化学反应,至今只成功制备出几百种稀有气体化合物。每种稀有气体的熔点和沸点十分接近,温度差距小于10 °C(18 °F),因此它们仅在很小的温度范围内以液态存在。
经气体液化和分馏方法可从空气中获得氖、氩、氪和氙,而氦气通常提取自天然气,氡气则通常由镭化合物经放射性衰变后分离出来。稀有气体在工业方面主要应用在照明设备、焊接和太空探测。氦也会应用在深海潜水。如潜水深度大于55米,潜水员所用的压缩空气瓶内的氮要由氦代替,以避免氧中毒及氮麻醉的徵状。另一方面,由于氢气非常不稳定,容易燃烧和爆炸,现今的飞艇及气球都采用氦气替代氢气。
名稱
惰性氣體在十九世紀被化學家發現以來,由於深入理解其性質而多次改名。最初稱為稀有氣體(rare gases),因為化學家認為它們很罕見。不過,這種說法只適用于其中部分气体,並非所有气体都很少見。例如氬氣(Ar, argon)在地球大氣層的含量占0.9%,勝過二氧化碳[3];而氦氣(He, helium)在地球大氣層的含量確實很少,但在宇宙卻是相當充沛,它佔有25%,僅次於氫。所以化學家又改稱為惰性氣體(又稱鈍氣,inert gases),表示它們在普通环境下没有反应性,即不发生化学反应,不曾在自然中出現過化合物。對於那些早期需藉由化合物來尋找元素的科學家來說,這些元素是比較難以尋找的。不過,最近研究指出它們是可以和其他元素結合成化合物的(此即稀有气体化合物[4]),只是需要借助人工合成的方式。故最後改稱為noble gas[5],這個稱呼是由雨果·埃德曼[6]於1898年所用的德语词Edelgas翻譯而來,表示它們具有极低的反应性,难以發生化學反應,但並非不能產生任何化合物,类比于与具有极低反应性的惰性金属(noble metal)[7]。
在中文譯名方面,兩岸三地有著不同的稱呼。中国大陆全国自然科学名词审定委员会於1991年公佈的《化学名词》中正式规定「noble gases」稱為稀有气体一词[8]。香港教育局的《中學化學科常用英漢辭彙》稱「noble gases」為(高)貴氣體[9],而一般社會仍有使用惰性氣體的稱呼[10]。而台灣方面,由國家教育研究院的國立編譯館建議常稱「noble gases」為惰性氣體,比較少用鈍氣(但審定高中以下化學課本統一使用鈍氣)、稀有氣體等[11],然而最近也有被稱為[7]。
发现史
1868年8月18日,皮埃尔·让森和约瑟夫·诺曼底·洛克伊尔在观测太阳的色球层时,发现一种发射光谱中有黄色谱线的物质,他们把该物质命名为“氦”(法語:、英語:),该词源自希腊语(ílios),意为“太阳”[12]。在他们之前,英国化学及物理学家亨利·卡文迪什已经在1784年在空气中发现一种微量的物质,其化学反应活性比氮气还低。一个世纪之后的1895年,瑞利勋爵比较空气中分离出的氮气和化学反应所产生的氮气,发现它们的密度有所不同。瑞利勋爵与伦敦大学学院的科学家威廉·拉姆齐合作,推测从空气提取的“氮气”与另一气体混合物。此后,他们通过实验顺利地分离一种新的元素:氩,此名称源自希腊语(argós),意思为“不活跃”[13]。由此发现,元素周期表上欠缺一整类的气体。在寻找氩气期间,拉姆齐重复美国地质学家希尔布兰德的实验,即把钇铀矿放在硫酸中加热,他通过此法成功的分离出氦气。1902年,德米特里·门捷列夫接受氦和氩元素的发现,并这些稀有气体纳入他的元素排列之内,分类为第0族,而元素周期表即从该排列演变而来[14]。
拉姆齐继续使用分馏法把液态空气分离成不同的成分以寻找其他的稀有气体。他于1898年发现三种新元素:氪、氖和氙。“氪”源自希腊语“(kruptós)”,意为“隐藏”;“氖”源自希腊语“(néos)”,意为“新”;“氙”源自希腊语“(xénos)”,意为“陌生人”。氡气于1898年由弗里德里希·厄恩斯特·当发现[15],最初取名为镭放射物,但当时并未列为稀有气体。直到1904年才发现它的特性与其他稀有气体相似[16]。1904年,瑞利和拉姆齐分别获得诺贝尔物理学奖和化学奖,以表彰他们在稀有气体领域的发现[17][18]。瑞典皇家科学院主席西德布洛姆致词说:“即使前人未能确认该族中任何一个元素,却依然能发现一个新的元素族,这是在化学历史上独一无二的,对科学发展有本质上的特殊意义[18]。”
稀有气体的发现有助于对原子结构一般理解的发展。在1895年,法国化学家亨利·莫瓦桑尝试进行氟(电负性最高的元素)与氩(稀有气体)之间的反应,但没有成功。直到20世纪末,科学家仍无法制备出氩的化合物,但这些尝试有助于发展新的原子结构理论。由这些实验结果,丹麦物理学家尼尔斯·玻尔於1913年提出,在原子中的电子以电子层形式围绕原子核排列,除了氦气以外的所有稀有气体元素的最外层的电子层总是包含8个电子[16]。1916年,吉尔伯特·路易斯制定八隅体规则,指出最外电子层上有8个电子是任何原子最稳定的排布;此电子排布使它们不会与其他元素发生反应,因为它们不需要更多的电子以填满其最外层电子层[19]。
1962年,尼尔·巴特利特发现首个稀有气体化合物六氟合铂酸氙[20]。其他稀有气体化合物随后陆续被发现:在1962年发现氡的化合物二氟化氡[21];并于1963年发现氪的化合物二氟化氪[22]。2000年,第一种稳定的氩化合物氟氩化氢(HArF)在40K(-233.2℃)下成功制备[23]。
1998年12月,俄罗斯杜布纳的联合核研究所的科学家以钙原子轰击钚,成功产生114号元素的单一原子[24],此元素后来被命名为鈇[25]。初步化学实验已显示鈇可能是第一种位於其他族,却有着稀有气体特性的超重元素[26]。2006年10月,联合核研究所与美国劳伦斯利福摩尔国家实验室的科学家成功地以钙原子轰击鉳的方法[27],人工合成,它是18族的第七个元素[28]。
物理和原子性质
| 性质[16][29] | 氦 | 氖 | 氩 | 氪 | 氙 | 氡 | |
|---|---|---|---|---|---|---|---|
| 主要化合價 | 0 | 不詳[30] | 0 | 0, +1, +2 | 0, +1, +2, +4, +6, +8 | 0, +2, +6 | -1[31], 0, +1[32], +2[33], +4[33], +6[31](推測) |
| 狀態(標況) | 氣體 | 氣體 | 氣體 | 氣體 | 氣體 | 氣體 | 固體(推測)[34] |
| 密度(g/L) | 0.1786 | 0.9002 | 1.7818 | 3.708 | 5.851 | 9.97 | 4.9–5.1g/cm3(推測)[35] |
| 沸点(K) | 4.4 | 27.3 | 87.4 | 121.5 | 166.6 | 211.5 | 350±30(推測)[34] |
| 熔点(K) | 0.95[36] | 24.7 | 83.6 | 115.8 | 161.7 | 202.2 | 不詳 |
| 沸点和熔点的差距 (K) | 3.45 | 2.6 | 3.8 | 5.7 | 4.9 | 9.3 | 不詳 |
| 汽化热(kJ/mol) | 0.08 | 1.74 | 6.52 | 9.05 | 12.65 | 18.1 | 19.4(推測)[37] |
| 20 °C时在水中的溶解度(cm3/kg) | 8.61 | 10.5 | 33.6 | 59.4 | 108.1 | 230 | 不詳 |
| 原子序数 | 2 | 10 | 18 | 36 | 54 | 86 | 118 |
| 原子半径(pm)[38] | 31 | 38 | 71 | 88 | 108 | 120 | 不詳 |
| 电离能(kJ/mol) | 2372 | 2080 | 1520 | 1351 | 1170 | 1037 | 860.1(推測)[39] |
| 电负度 | 4.16 | 4.79 | 3.24 | 2.97 | 2.58 | 2.2 | 不詳 |
关于更多数据,参见稀有氣體性質表。
由于稀有气体无极性且相对分子质量较小,因而它们的分子间作用力非常弱,所以熔点和沸点非常低[40]。它们在标准状况下都是单原子气体,甚至比一般固体元素原子量更大的氙、氡等也是这样[16]。氦与其它稀有气体元素相比,具有一些独特的性质:它的沸点和熔点低于其它任何已知的物质;它是唯一的一种表现出超流性的元素;它是唯一不能在标准状况下冷却凝固的元素——必须在0.95 K(−272.200℃)的温度施加25个大气压(2,500 kPa)的压力,才能使它凝固[41]。到氙为止的稀有气体都有多个稳定的同位素,氡和则没有稳定同位素。氡寿命最长的同位素222Rn的半衰期只有3.8天,氡会衰变为氦和钋,最终衰变产物则是铅[16];而目前已知的同位素的半衰期均以毫秒計。
稀有气体原子像大部分族中的原子一样,由于电子层数的增加,原子半径随着周期的增加而增加。原子的大小与影响物质的许多性质。例如,电离能随着半径的增加而减少,因为较重的稀有气体中的价电子离核较远,因此更容易脱离原子核的束缚。稀有气体的电离能是每一个周期中最大的,这反映了它们的电子排布的稳定性,也导致了它们的化学性质不活泼[29]。然而,有些较重的稀有气体的电离能较小,足以与其它元素和分子相比。巴特利特正是看到了氙的第一电离能与氧分子相似,而尝试用六氟化铂来把氙氧化,因为六氟化铂的氧化性非常强,足以把氧气氧化[20]。稀有气体不能得到一个电子,而形成稳定的阴离子;也就是说,它们的电子亲合能是负值[42][43]。

稀有气体的宏观物理性质主要来自原子之间的弱范德华力。原子之间的吸引力随着原子大小的增加而增加,由于极化性的增加以及电离能的减少。这就是在第18族从上到下,原子半径和原子间力增加,导致熔点、沸点、汽化热和溶解度增加的原因。密度的增加则是由于原子序数的增加[29]。
稀有气体在标准状况下几乎是理想气体,但它们与理想气体状态方程的偏差提供了分子间作用力的研究的重要线索。兰纳-琼斯势,通常用来模拟分子间的作用,由约翰·兰纳-琼斯根据氖的实验数据提出,那时量子力学还没有发展到可以作为从第一性原理(即量子化学从头计算)理解分子间作用力的工具[44]。这些作用的理论分析变得易于处理,因为稀有气体是单原子,且原子是球形,这意味着原子之间的作用与方向无关(各向同性)[40]。
化学性质


稀有气体组成了元素周期表中的第18族。已经确认的元素是氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)、氡(Rn)和(Og)[45],前六者在标准状况下都是无色、无气味、无味道、不可燃的气体。曾经有一段时间,它们被称为元素周期表中的第0族,因为大家认为它们的化合价为零,也就是说,它们的原子不能与其它元素结合而形成化合物。然而,后来发现有些稀有气体确实可以形成化合物(氖除外),这样“第0族”的名称便再没有人使用了[16]。目前对第18族的最新元素了解非常少[46]。
与其他主族一样,此族元素的电子排布有固定的模式,尤其是主导化学性质变化趋势的最外层电子:
| Z | 元素 | 电子数目/电子层 |
|---|---|---|
| 2 | 氦 | 2 |
| 10 | 氖 | 2, 8 |
| 18 | 氩 | 2, 8, 8 |
| 36 | 氪 | 2, 8, 18, 8 |
| 54 | 氙 | 2, 8, 18, 18, 8 |
| 86 | 氡 | 2, 8, 18, 32, 18, 8 |
| 118 | 2, 8, 18, 32, 32, 18, 8(預測) |
稀有气体的价电子层已满。价电子是最外层的电子,通常只有这些电子参与化学键。价电子层已满的原子是非常稳定的,因此很难形成化学键,也极难得到或失去电子[47]。然而,在较重的稀有气体中(例如氡),最外层的电子与原子核之间的电磁力要小于较轻的稀有气体(例如氦),因此较重的稀有气体较容易失去最外层电子[48]。
稀有气体记法
由于价电子层已满,因此稀有气体可以与电子排布记法结合起来,形成稀有气体记法。这种记法是先写出元素之前的最近的稀有气体,然后再写出从那里开始的电子排布。例如,碳的电子排布是1s22s22p2,稀有气体记法则是[He]2s22p2。使用这种记法更容易识别元素,也比完整的原子轨道记法要简短[49]。
化合物
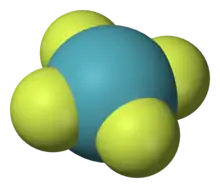
稀有气体的化学反应活性极低;因此,目前只制备出了数百个稀有气体化合物。氦和氖参与化学键的中性化合物目前还没有成功制备(虽然理论上少数氦的化合物是可以存在的),氡、氙、氪和氩也只表现出极低的活性[50]。根据艾伦电负性的大小,可知反应活性的顺序为Ne < He < Ar < Kr < Xe < Rn < Og。
1933年,莱纳斯·鲍林预言较重的稀有气体可以与氟和氧反应,生成化合物。他预言了六氟化氪(KrF6)和六氟化氙(XeF6)的存在,推测XeF8可能存在但不稳定,也预测了氙酸可以转化成氙酸盐[51][52]。目前已经证明了这些预言基本上是准确的,只有XeF8已知不但热力学上不稳定,动力学上也不稳定[53]。
氙的化合物是稀有气体化合物中数量最繁多的[54]。在大部分这些化合物中,氙原子的氧化态都是+2、+4、+6或+8,与电负性很高的原子如氟或氧键合,例如二氟化氙(XeF2)、四氟化氙(XeF4)、六氟化氙(XeF6)、四氧化氙(XeO4)以及高氙酸钠(Na4XeO6)。其中有些化合物可以在化学合成中作为氧化剂,特别是XeF2可以作为氟化剂[55]。到2007年为止,已经制备出了大约五百种氙与其它元素键合的化合物,包括有机氙化合物(氙与碳原子键合),以及氙与氮、氯、金、汞和氙本身键合的化合物[50][56]。氙与硼、氢、溴、碘、铍、硫、钛、铜和银键合的化合物也已制得,但只能在低温的稀有气体基质或超音速稀有气体射流中存在[50]。
理论上,氡比氙要更活泼,因此应该比氙更容易与其它原子键合。然而,由于氡的同位素的高度放射性和极短的半衰期,实际上只制备出了少数氡的氟化物和氧化物[57]。
氪没有氙活泼,但仍然制备出了一些氪的化合物,其中氪的氧化态为+2[50]。二氟化氪是最重要和最容易制备的氪化合物。氪与氮和氧键合的化合物也已制得[58],但分别只在−60 °C(−76.0 °F)和−90 °C(−130.0 °F)以下稳定[50]。
氪原子与其它非金属(氢、氯和碳)以及一些过渡金属(铜、银、金)键合的化合物也已制得,但只能存在于低温的稀有气体基质或超音速稀有气体射流中。2000年用类似的条件制备了最初几个氩化合物,例如氟氩化氢(HArF),以及一些氩与过渡金属铜、银、金键合的化合物。到2007年为止,还没有成功制备出含有氦或氖的共价键的化合物[50]。
稀有气体(包括氦)可以在气相中形成稳定的多原子离子。最简单的1925年发现的氦合氢离子(HeH+)[59]。因为它含有宇宙中最丰富的两种元素:氢和氦,因此被认为广泛存在于星际介质中[60]。除此以外,还有许多已知的稀有气体准分子。这些化合物比如ArF和KrF只能在激发态稳定存在,其中一些被应用于准分子激光器。
稀有气体原子除了形成共价分子,还能形成非共价化合物。它们的包合物最早于1949年报道[61],这类化合物中一个稀有气体原子被特定的无机或有机配体容纳在晶格中。它们形成的必要条件是稀有气体原子的大小必须与配体晶格的大小匹配。例如氩、氪和氙能与氢醌形成包合物,而氦和氖却不能,因为它们太小并且可极化性不够强[62]。氖、氩、氪和氙还能形成由冰的晶格容纳稀有气体原子的水合物[63]。

稀有气体能形成由富勒烯分子容纳稀有气体原子的内嵌富勒烯。1993年时发现60个碳原子的球状分子C
60,可以与高压的稀有气体反应形成诸如He2C
60的配合物(2这个记号表示氦原子在C
60分子内,而不是与它形成共价键)[64]。截止2008年,富勒烯与氦、氖、氩、氪和氙的配合物都已制得[65]。这些化合物的用途主要是通过稀有气体原子的核磁共振波谱来研究富勒烯的结构和反应性[66]。

2成键的三中心四电子键模型
稀有气体化合物例如二氟化氙(XeF
2)被视作超价分子,因为它们违反了超價分子。这些化合物的成键可以使用三中心四电子键模型来解释[67][68]。这种模型于1951年首次提出,描述了三个共线原子的成键状况。例如XeF
2中的成键可以用三个原子的p轨道进行线性组合形成分子轨道来描述,氙原子全满的p轨道与每个氟原子半满的p轨道重叠,形成一个全满的成键轨道、一个全满的非键轨道和一个全空的反键轨道。最高占有分子轨道(HOMO)定域在两个端基原子上,这表明氟的高电负性促进了电荷的定域化[69]。
较重稀有气体氪和氙的化学已有了长足的发展,而较轻稀有气体氖和氦仍处于开始阶段,而最稳定的氖至今仍没有一种确认存在的化合物,目前只发现了一些不稳定的阳离子和未经证实的水合物[70]。
自然存在与制备
稀有气体在宇宙中的丰度随着原子序数的增大而降低。氦是宇宙中仅次于氢的最丰富的元素之一,质量分数大约为24%。宇宙中的大部分氦都是在太初核合成中形成的,但是由于恒星核合成中的氢的聚变,氦的数量仍在不断增加[71][72]。地球上的丰度则完全不同,氦仅仅是大气中第三丰富的稀有气体。这种不同的原因是大气层中没有太初氦,因为原子质量太小,氦无法被地球的引力场吸引在地球表面附近。地球上的氦来自地壳中重元素(例如铀和钍)的α衰变,这样产生的氦往往积聚在天然气田中[73]。另一方面,较丰富的氩来自于钾-40的β衰变。钾-40同样存在于地壳中,它产生的氩-40是地球上最丰富的氩同位素,尽管它在太阳系中相当稀少。这个过程是钾氩测年法的理论基础[74]。氙在大气中的丰度比预想的要低,这被称作“氙失踪问题”(英語:)。有一种理论认为缺少的氙可能被限制在地壳的矿石中[75]。二氧化氙发现后,有研究认为氙能取代硅酸中的硅从而固定在地壳中。[76]氡在岩石圈中通过镭的α衰变生成。它会通过裂缝逸出石材进入建筑物,并在通风不佳的建筑物内积聚。因为氡的放射性很强,它对人体健康有很大的危害。估计仅在美国每年就有21000人死于氡引发的肺癌[77]。至於則不存在於自然界中,只能透過粒子加速器人工合成。
| 丰度 | 氦 | 氖 | 氩 | 氪 | 氙 | 氡 |
|---|---|---|---|---|---|---|
| 太阳系(以硅原子为相对标准)[78] | 2343 | 2.148 | 0.1025 | 5.515 × 10−5 | 5.391 × 10−6 | – |
| 地球大气(体积分数,单位:ppm)[79] | 5.20 | 18.20 | 9340.00 | 1.10 | 0.09 | (0.06–18) × 10−19[80] |
| 火成岩(质量分数,单位:ppm)[29] | 3 × 10−3 | 7 × 10−5 | 4 × 10−2 | – | – | 1.7 × 10−10 |
氖、氩、氪和氙都是从空气中使用气体液化的方法获得的,先将各种气体液化,再根据沸点不同来分馏,将混合物分离成不同的馏分。氦通常提取自天然气,而氡可以从镭化合物放射性衰变的产物中分离出来[16]。稀有气体的价格取决于他们的自然丰度,因此氩最便宜而氙最昂贵。右侧的表格给出了2004年时实验量的各种稀有气体在美国的销售价格。
应用
稀有气体的熔沸点非常低,是用途广泛的低温学工作介质[82]。特别是沸点低达4.2K(−268.95 °C)的液氦可以用于冷却核磁共振成像和核磁共振波谱法所需的超导磁铁[83]。尽管液氖的冷却温度没有液氦那么低,但是仍在低温学中广泛使用,因为它的制冷量是液氦的40倍、液氢的3倍[80]。
因为氦在液体尤其是脂质中的溶解度较低,它在潜水员的呼吸气体中代替了氮气。人受到类似于水肺潜水的压力时,气体会被血液和人体组织吸收,这会造成氮麻醉的严重后果[84]。因为溶解度远比氮气小,少量的氦被带入细胞膜。而用氦代替呼吸混合气中的部分成分时(例如三混气和氦氧混合剂),潜入较深后上浮时的麻醉反应可以大大减轻[85]。氦的低溶解性为减压病提供了很好的解决方案[16][86]。由于溶解在体内的气体减少,上浮时由于减压而形成的气泡将大大减少。另一种稀有气体氩被视作水中呼吸器潜水最好的防水衣填充气体[87]。氦也用作核反应堆中核燃料棒的填充气体[88]。

自从1937年的兴登堡灾难以来[89],尽管相对氢气会使浮力降低8.6%,但因密度小且不可燃,各国普遍使用氦气代替氢气填充飞艇和气球[16][90]。
稀有气体在许多场合中用于提供惰性气氛。氩在化学合成时常用于保护对氮气敏感的化合物。固态氩也用于研究活性中間體等非常不稳定的化合物,方法是在超低温下将其隔离在固态氩构成的基质中[91]。氦是气相色谱法中的载色剂、温度计的填充气,并用于盖革计数器和气泡室等辐射测量设备中[81]。氦和氩都用作焊接电弧的保护气和贱金属的焊接及切割的惰性保护气。它们在其他冶金过程和半导体工业中硅的生产中同样有着广泛应用[80]。


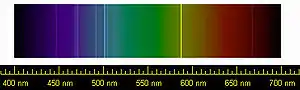
由于化学活性很低,稀有气体广泛的应用于照明领域。氩和氮的混合气体是白炽灯中填充的保护气。氪可降低灯丝的蒸发率而常用于色温和效率更高性能白炽灯,特别在卤素灯中可将氪与少量碘或溴的化合物混合充入。此外,在放电灯中填充不同的稀有气体,可以产生不同颜色的光,如霓虹灯中常见的氖灯。尽管称为氖灯,其中通常含有其他气体和磷,它们在氖发出的橙红色光的基础上加入了其他颜色。氙通常用于氙弧灯,因为它们的近连续光谱与日光相似。这种灯可用于电影放映机和汽车前灯等[80]。
稀有气体可用于准分子激光器,这是因为它们可形成短暂存在的电子激发态受激子[92](英語:)。这些用于激光器的受激子可能是稀有气体二聚体,例如Ar2、Kr2或Xe2,更有可能是与卤素结合的受激子,例如ArF、KrF、XeF或XeCl。这些激光器产生波长较短的紫外线,其中ArF产生的紫外线波长为193纳米,而KrF为248纳米。这种高频率的激光使高精密成像成为现实。准分子激光有诸多工业、医药和科学用途。集成电路制造过程中的显微光刻法和微制造必须用到准分子激光。激光手术,例如血管再成形术和眼部手术也需用到准分子激光[93]。
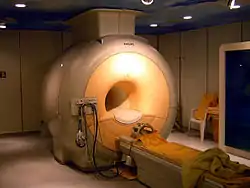
一些稀有气体有直接的医学用途,如:氦有时用于改善哮喘患者的呼吸[80];氙则因为在脂质中的高溶解度成为一种麻醉剂,比常用的一氧化二氮(俗称笑气)更为有效,且容易从体内排出而麻醉后苏醒也较快[94]。氙在超极化核磁共振成像中用于拍摄肺的医学影像[95]。具有强辐射性的氡只能微量制取,可用于放射线疗法[16]。
参考文献
注脚
- Kaldor, Uzi; Wilson, Stephen. . Springer. 2003: 105. ISBN 140201371X.
- (PDF). JINR. [2009-08-08]. (原始内容 (PDF)存档于2011-10-06).
- . Encyclopedia Britannica. [2020-12-22] (英语).
- Ozima 2002,第30页
- Ozima 2002,第4页
- Renouf, E. . Science. 1901-02-15, 13 (320): 268–270. ISSN 0036-8075. doi:10.1126/science.13.320.268 (英语).
- Peter W. Athkins 著 欧姿涟 译. . 台北: 天下文化出版社. 1996.
- 北京师范大学、华中师范大学、南京师范大学无机化学教研室. . 北京: 高等教育出版社. 2003: P444. ISBN 9-787040-115833.
- 中學化學科常用英漢辭彙 的存檔,存档日期2015-05-18.
- . 文匯報. 2006-11-17 [2012-02-26]. (原始内容存档于2010-05-23).
- 國家教育研究院. . [2013-06-17]. (原始内容存档于2014-03-02).
- Oxford English Dictionary(1989),s.v. "helium". Retrieved December 16, 2006, from Oxford English Dictionary Online. Also, from quotation there: Thomson, W. (1872). Rep. Brit. Assoc. xcix: "Frankland and Lockyer find the yellow prominences to give a very decided bright line not far from D, but hitherto not identified with any terrestrial flame. It seems to indicate a new substance, which they propose to call Helium."
- Ozima 2002,第1页
- Mendeleev 1903,第497页
- Partington, J. R. . Nature. 1957-05, 179 (4566): 912–912. ISSN 0028-0836. doi:10.1038/179912a0 (英语).
- . Encyclopedia Britannica. [2020-12-22] (英语).
- Cederblom, J. E. . 1904. (原始内容存档于2008-05-13).
- Cederblom, J. E. . 1904. (原始内容存档于2008-06-15).
- Gillespie, R. J.; Robinson, E. A. . Journal of Computational Chemistry. 2007-01-15, 28 (1): 87–97. ISSN 0192-8651. PMID 17109437. doi:10.1002/jcc.20545.
- . Proceedings of the Chemical Society. 1962, (June): 197. ISSN 0369-8718. doi:10.1039/ps9620000197 (英语).
- Fields, Paul R.; Stein, Lawrence.; Zirin, Moshe H. . Journal of the American Chemical Society. 1962-11, 84 (21): 4164–4165. ISSN 0002-7863. doi:10.1021/ja00880a048 (英语).
- Grosse, A. V.; Kirshenbaum, A. D.; Streng, A. G.; Streng, L. V. . Science. 1963-03-15, 139 (3559): 1047–1048. ISSN 0036-8075. doi:10.1126/science.139.3559.1047 (英语).
- Khriachtchev, Leonid; Pettersson, Mika; Runeberg, Nino; Lundell, Jan; Räsänen, Markku. . Nature. 2000-08, 406 (6798): 874–876. ISSN 0028-0836. doi:10.1038/35022551 (英语).
- Oganessian, Yu. Ts.; Utyonkov, V. K.; Lobanov, Yu. V.; Abdullin, F. Sh.; Polyakov, A. N.; Shirokovsky, I. V.; Tsyganov, Yu. S.; Gulbekian, G. G.; Bogomolov, S. L. . Physical Review Letters. 1999-10-18, 83 (16): 3154–3157. ISSN 0031-9007. doi:10.1103/PhysRevLett.83.3154 (英语).
- Woods, Michael. . Pittsburgh Post-Gazette. 2003-05-06 [2008-06-26]. (原始内容存档于2009-03-23).
- (PDF). Texas A&M University. [2008-05-31]. (原始内容 (PDF)存档于2008-05-28).
- Oganessian, Yu. Ts.; Utyonkov, V. K.; Lobanov, Yu. V.; Abdullin, F. Sh.; Polyakov, A. N.; Sagaidak, R. N.; Shirokovsky, I. V.; Tsyganov, Yu. S.; Voinov, A. A. . Physical Review C. 2006-10-09, 74 (4): 044602. ISSN 0556-2813. doi:10.1103/PhysRevC.74.044602 (英语).
- Wilson, Elaine. . Electronic Journal of Literacy through Science. 2005, 4 (2).
- Greenwood 1997,第891页
- 氖仍未合成任何化合物。
- Haire, Richard G. . Morss; Edelstein, Norman M.; Fuger, Jean (编). 3rd. Dordrecht, The Netherlands: Springer Science+Business Media. 2006: 1724. ISBN 1-4020-3555-1.
- Han, Young-Kyu; Bae, Cheolbeom; Son, Sang-Kil; Lee, Yoon Sup. . The Journal of Chemical Physics. 2000-02-08, 112 (6): 2684–2691. ISSN 0021-9606. doi:10.1063/1.480842 (英语).
- Kaldor, Uzi; Wilson, Stephen. . Springer. 2003: 105 [2008-01-18]. ISBN 140201371X.
- Nash, Clinton S. . The Journal of Physical Chemistry A. 2005-04, 109 (15): 3493–3500. ISSN 1089-5639. doi:10.1021/jp050736o (英语).
- Bonchev, D.; Kamenska, Verginia. . The Journal of Physical Chemistry. 1981-04, 85 (9): 1177–1186. ISSN 0022-3654. doi:10.1021/j150609a021 (英语).
- 在25 巴的压力下
- Eichler, R.; Eichler, B., (PDF), Paul Scherrer Institut, [2010-10-23], (原始内容 (PDF)存档于2011-07-07)
- . ptable.com. [2020-12-22] (中文(台灣)).
- Pershina, Valeria. . Schädel, Matthias; Shaughnessy, Dawn (编). 2nd. Springer Science & Business Media. : 154. ISBN 9783642374661.
- 冯光熙、黄祥玉. . 北京: 科学出版社. 1984: P15.
- . University of Alberta. [2008-06-22]. (原始内容存档于2008-02-12).
- Wheeler, John C. . Journal of Chemical Education. 1997-01, 74 (1): 123. ISSN 0021-9584. doi:10.1021/ed074p123 (英语).
- Kalcher, Josef; Sax, Alexander F. . Chemical Reviews. 1994-12, 94 (8): 2291–2318. ISSN 0009-2665. doi:10.1021/cr00032a004 (英语).
- Mott, Nevill Francis. . Biographical Memoirs of Fellows of the Royal Society. 1955-11-01, 1: 174–184. doi:10.1098/rsbm.1955.0013.
- Ozima 2002,第2页
- Weiss, Rick. . 2006-10-17 [2020-12-22]. ISSN 0190-8286 (美国英语).
- Ozima 2002,第35页
- 这是在经典力学范围内使用库仑定律推导出的,在定性判断时也适用。
- CliffsNotes 2007,第15页
- Grochala, Wojciech. . Chemical Society Reviews. 2007, 36 (10): 1632. ISSN 0306-0012. doi:10.1039/b702109g (英语).
- Pauling, Linus. . Journal of the American Chemical Society. 1933-05, 55 (5): 1895–1900. ISSN 0002-7863. doi:10.1021/ja01332a016 (英语).
- Holloway 1968
- Seppelt, Konrad. . Accounts of Chemical Research. 1979-06, 12 (6): 211–216. ISSN 0001-4842. doi:10.1021/ar50138a004 (英语).
- Moody, G. J. . Journal of Chemical Education. 1974-10, 51 (10): 628. ISSN 0021-9584. doi:10.1021/ed051p628 (英语).
- Zupan, Marko; Iskra, Jernej; Stavber, Stojan. . The Journal of Organic Chemistry. 1998-02, 63 (3): 878–880. ISSN 0022-3263. doi:10.1021/jo971496e (英语).
- Harding 2002,第90–99页
- Avrorin, V V; Krasikova, R N; Nefedov, V D; Toropova, M A. . Russian Chemical Reviews. 1982-01-31, 51 (1): 12–20. ISSN 0036-021X. doi:10.1070/RC1982v051n01ABEH002787.
- Lehmann, J. . Coordination Chemistry Reviews. 2002-11-01,. 233-234: 1–39. doi:10.1016/S0010-8545(02)00202-3.
- Hogness, T. R.; Lunn, E. G. . Physical Review. 1925-07-01, 26 (1): 44–55. ISSN 0031-899X. doi:10.1103/PhysRev.26.44 (英语).
- Fernández, J; Martín, F. . Journal of Physics B: Atomic, Molecular and Optical Physics. 2007-06-28, 40 (12): 2471–2480. ISSN 0953-4075. doi:10.1088/0953-4075/40/12/020.
- Powell, H. M.; Guter, M. . Nature. 1949-08, 164 (4162): 240–241. ISSN 0028-0836. doi:10.1038/164240b0 (英语).
- Greenwood 1997,第893页
- Dyadin, Yuri A.; Larionov, Eduard G.; Manakov, Andrei Yu.; Zhurko, Fridrich V.; Aladko, Evgeny Ya.; Mikina, Tamara V.; Komarov, Vladislav Yu. . Mendeleev Communications. 1999-01, 9 (5): 209–210. doi:10.1070/MC1999v009n05ABEH001104 (英语).
- Saunders, M.; Jimenez-Vazquez, H. A.; Cross, R. J.; Poreda, R. J. . Science. 1993-03-05, 259 (5100): 1428–1430. ISSN 0036-8075. doi:10.1126/science.259.5100.1428 (英语).
- Saunders, M.; Jimenez-Vazquez, H. A.; Cross, R. J.; Mroczkowski, S.; Gross, M. L.; Giblin, D. E.; Poreda, R. J. . ChemInform. 2010-08-19, 25 (28): no–no. doi:10.1002/chin.199428026 (英语).
- Frunzi, Michael; Cross, R. James; Saunders, Martin. . Journal of the American Chemical Society. 2007-10-31, 129 (43): 13343–13346. ISSN 0002-7863. PMID 17924634. doi:10.1021/ja075568n.
- Greenwood 1997,第897页
- Weinhold 2005,第275–306页
- Pimentel, George C. . The Journal of Chemical Physics. 1951-04, 19 (4): 446–448. ISSN 0021-9606. doi:10.1063/1.1748245 (英语).
- Hammond, C.R. (PDF). CRC press. 2000: 19. ISBN 0849304814. (原始内容存档 (PDF)于2008-06-26).
- Weiss, Achim. . Max Planck Institute for Gravitational Physics. [2008-06-23]. (原始内容存档于2007-02-08).
- Coc, Alain; Vangioni‐Flam, Elisabeth; Descouvemont, Pierre; Adahchour, Abderrahim; Angulo, Carmen. . The Astrophysical Journal. 2004-01-10, 600 (2): 544–552. ISSN 0004-637X. doi:10.1086/380121 (英语).
- Morrison, P.; Pine, J. . Annals of the New York Academy of Sciences. 1955-09, 62 (3 Radiogenic Or): 71–92. ISSN 0077-8923. doi:10.1111/j.1749-6632.1955.tb35366.x (英语).
- Scherer, Alexandra. . Technische Universität Bergakademie Freiberg. 2007-01-16 [2008-06-26]. (原始内容存档于2007-10-14).
- Sanloup, C. . Science. 2005-11-18, 310 (5751): 1174–1177. ISSN 0036-8075. doi:10.1126/science.1119070 (英语).
- Tyler Irving. . L’Actualité chimique canadienne (Canadian Chemical News). May 2011 [2012-05-18]. (原始内容存档于2013-02-09).
- . U.S. Environmental Protection Agency. 2007-11-26 [2008-06-26]. (原始内容存档于2008-05-16).
- Lodders, Katharina. . The Astrophysical Journal. 2003-07-10, 591 (2): 1220–1247. ISSN 0004-637X. doi:10.1086/375492 (英语).
- . National Weather Service. [2008-06-01]. (原始内容存档于2008-03-28).
- Häussinger, Peter; Glatthaar, Reinhard; Rhode, Wilhelm; Kick, Helmut; Benkmann, Christian; Weber, Josef; Wunschel, Hans-Jörg; Stenke, Viktor; Leicht, Edith. . Wiley-VCH Verlag GmbH & Co. KGaA (编). . Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. 2001-03-15: a17_485. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a17_485 (英语).
- Hwang, Shuen-cheng; Weltmer, William R. . John Wiley & Sons, Inc. (编). . Hoboken, NJ, USA: John Wiley & Sons, Inc. 2000-12-04: 0701190508230114.a01. ISBN 978-0-471-23896-6. doi:10.1002/0471238961.0701190508230114.a01 (英语).
- . . 2008.
- Zhang, C.J.; Zhou, X.T.; Yang, L. . IEEE Transactions on Magnetics. Jan./1992, 28 (1): 957–959. doi:10.1109/20.120038.
- Fowler, B.; Ackles, K. N.; Porlier, G. . Undersea Biomedical Research. 1985-12, 12 (4): 369–402. ISSN 0093-5387. PMID 4082343.
- Bennett 1998,第176页
- Vann, R. D. (ed). . 38th Undersea and Hyperbaric Medical Society Workshop. 1989,. 75(Phys)6-1-89: 437 [2008-05-31]. (原始内容存档于2010-01-05).
- Maiken, Eric. . Decompression. 2004-08-01 [2008-06-26]. (原始内容存档于2008-07-01).
- Horhoianu, G; Ionescu, D.V; Olteanu, G. . Annals of Nuclear Energy. 1999-11, 26 (16): 1437–1445. doi:10.1016/S0306-4549(99)00022-5 (英语).
- . The New York Times. 1937-05-07: 1.
- Freudenrich, Craig. . HowStuffWorks. 2008 [2008-07-03]. (原始内容存档于2008-08-10).
- Dunkin, I. R. . Chemical Society Reviews. 1980, 9 (1): 1. ISSN 0306-0012. doi:10.1039/cs9800900001 (英语).
- 这是全国科学技术名词审定委员会提供的译名,参见其查询结果
- Basting, Dirk; Marowsky, Gerd. . Springer. 2005. ISBN 3-540-20056-8.
- Sanders, Robert D.; Ma, Daqing; Maze, Mervyn. . British Medical Bulletin. 2004, 71: 115–135. ISSN 0007-1420. PMID 15728132. doi:10.1093/bmb/ldh034.
- Albert, M. S.; Balamore, D. . Nuclear Instruments & Methods in Physics Research. Section A, Accelerators, Spectrometers, Detectors and Associated Equipment. 1998, 402: 441–453. ISSN 0168-9002. PMID 11543065. doi:10.1016/s0168-9002(97)00888-7.
- Ray, Sidney F. . Focal Press. 1999: 383–384. ISBN 978-0-240-51323-2 (英语).
参考书目
- Bennett, Peter B.; Elliott, David H. . SPCK Publishing. 1998. ISBN 0-7020-2410-4.
- Bobrow Test Preparation Services. . CliffsNotes. 2007-12-05. ISBN 0-470-13500-X.
- Greenwood, N. N.; Earnshaw, A. 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- Harding, Charlie J.; Janes, Rob. . Royal Society of Chemistry. 2002. ISBN 0-85404-690-9.
- Holloway, John H. . London: Methuen Publishing. 1968. ISBN 0-412-21100-9.
- Mendeleev, D. 7th. 1902–1903.
- Ojima, Minoru; Podosek, Frank A. . Cambridge University Press. 2002. ISBN 0-521-80366-7.
- Weinhold, F.; Landis, C. . Cambridge University Press. 2005. ISBN 0-521-83128-8.
| 左方一族: | 稀有气体 第18族(0) |
| 卤素 |
|---|